
| A. | ①和④ | B. | ②和③ | C. | ④和⑤ | D. | ①②③④⑤ |
分析 同温同压下等体积的CO和CO2的物质的量相同,则分子数相等,碳原子个数相等,根据物质的量和相对分子质量计算质量关系和密度关系.
解答 解:①同温同压下等体积的CO和CO2的物质的量相同,则分子数相等,即所含的分子数目之比为1:1,故正确;
②同温同压下等体积的CO和CO2的物质的量相同,则分子数相等,所含的O原子数目之比为1:2,故正确;
③同温同压下等体积的CO和CO2的物质的量相同,则分子数之比为1:1,所含的原子总数目之比为2:3,故正确;
④同温同压下等体积的CO和CO2的物质的量相同,两者的密度之比等于摩尔质量之比为:7:11,故正确;
⑤同温同压下等体积的CO和CO2的物质的量相同,每个分子含有的电子数分别为14、22,则所含的电子数目之比为7:11,故正确.
故选D.
点评 本题考查物质的量的有关计算,以及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | B. | Cl-的结构示意图: | ||
| C. | H2O的电子式: | D. | H2O的电离方程式:H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
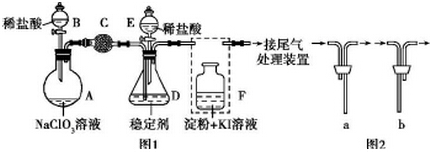
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2→MnO4- | B. | Al(OH)4-→Al(OH)3 | C. | SO32-→SO42- | D. | MnO2→MnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸溶液的物质的量浓度大于碱溶液的物质的量浓度 | |
| B. | 酸溶液中H+的浓度小于碱溶液中0H-的浓度 | |
| C. | 酸和碱混合时,碱过量 | |
| D. | 酸溶液的pH与碱溶液pH之和为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁与稀H2SO4反应 | B. | FeO与H2SO4反应 | ||
| C. | FeCO3与H2SO4稀反应 | D. | Fe(OH)3与稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2和Na2O都是白色固体,都能与冷水作用得到O2和NaOH | |
| B. | 在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 | |
| C. | 相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1 | |
| D. | Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com