
【题目】为测定某有机化合物A的结构,进行了如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况)。则该有机物中各元素的原子个数比是 。
(2)该有机化合物的相对分子质量为46,则其分子式是 。
(3)预测A的可能结构并写出结构简式 。
【结构简式的确定】
(4)经测定,在标准状况下0.2mol有机物A与足量金属钠反应生成2.24L的氢气,则A的结构简式为 。理由__________________。
【性质实验】
(5)A在一定条件下脱水可生成B,用B制备氯乙烷原子利用率为100%,请写出上述由B制备氯乙烷反应的化学方程式: 。
【答案】(1)C:H:O=2:6:1 (2)C2H6O (3)C2H5OH CH3OCH3
(4)C2H5OH 2mol有机物与钠反应生成1摩H2 ,说明有机物分子中含一个活泼氢原子
(5)CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
【解析】
试题分析:(1)根据元素守恒,n(H)=![]() =0.6mol,n(C)=8.8g÷44mol=0.2mol,根据氧元素守恒,有机物的氧n(O)+
=0.6mol,n(C)=8.8g÷44mol=0.2mol,根据氧元素守恒,有机物的氧n(O)+![]() =5.4g÷18g/mol+
=5.4g÷18g/mol+![]() ,解得:n(O)=0.1mol,则n(C):n(H):n(O)=0.2:0.6:0.1=2:6:1;
,解得:n(O)=0.1mol,则n(C):n(H):n(O)=0.2:0.6:0.1=2:6:1;
(2)有机物的最简式为C2H6O,分子量为46,则分子式为C2H6O;
(3)醇和醚互为同分异构体,可能结构简式为CH3CH2OH、CH3OCH3;
(4)能和金属钠反应,说明含有羟基,物质类别属于醇,其结构简式为CH3CH2OH。根据题目中所给数量关系,1mol该有机物能生成0.5mol氢气,说明A中有一个氢原子不同于其它五个原子,即机物分子中含一个活泼氢原子;
(5)乙醇脱水得到B,用B制备氯乙烷原子利用率为100%,说明发生消去反应,即B为CH2=CH2,B和HCl发生加成反应的方程式为CH2=CH2+HCl![]() CH3CH2Cl。
CH3CH2Cl。


科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 (填元素符号)。
(2)E的电子式为 。
(3)B、C、D简单离子的半径由大到小的顺序为 (填离子符号)。
(4)B和D非金属性较强的是 (填元素符号)。
(5)写出D的最高价氧化物的水化物和A单质反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置__________________。
(2)化合物乙的电子式为_____________,用电子式表示形成化合物丁的过程_____ 。
(3)写出丙与甲反应的离子方程式:___________________。
(4)固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O2–在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的负极为____(填a或b);O2–流向____极(填“正”或“负”);该电池的正极反应式为 _____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.铅蓄电池是二次电池
B.碱性锌锰电池不是一次电池
C.一般化学电池的活性物质储存在电池内部,限制了电池容量
D.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用正确的序号填空:
①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
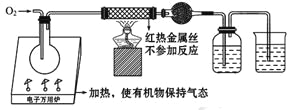
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是: 、______________________、______________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为_______,它可能属于_______(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为: 。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写于下表中:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如右图所示。下列叙述正确的是

A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修物质结构与性质]
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一。浓缩海水中的Br-、Mg2+可通过一系列工艺流程提取出来。
(1)如图是采用膜分离技术淡化海水的示意图,淡化膜可让水分子通过,而海水中其他离子不能通过。加压后,左侧海水中增加的是 (填字母)
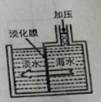
A.溶质质量
B.溶剂质量
C.溶质的质量分数
(2)在浓缩海水中通入氯气,生成Br2,有关的离子方程式是________ _____,该反应中的氧化剂是_____________,生成的Br2可用热空气法吹出的原因_____________。
(3)从海水中提取镁的主要步骤如下:

①操作a是
②试剂X是 ,A与X反应的离子方程式 。
③为检验MgCl2溶液中是否含有NaCl残留,实验操作是 。
④生产出的镁在运输途中应防雨淋,原因是 (用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com