
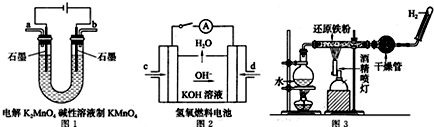
分析 ①阳极上失电子发生氧化反应.
②根据氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水.
③根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子
解答 解:①阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42--e-=MnO4-.
故答案为:MnO42--e-=MnO4-;
②氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,反应式为H2-2e-+2OH-=2H2O.
故答案为:H2-2e-+2OH-=2H2O;
③铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,
离子方程式为:2Fe3++Fe=3Fe2+,所以说不严密.
故答案为:不严密; 2Fe3++Fe=3Fe2+.
点评 本题考察了电化学知识.易错点是氢氧燃料电池中电极的判断,明确溶液中离子的移动方向是解此题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Fe3+溶液中滴加过量的氨水:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H20 | |
| D. | NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com