
【题目】σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )
A.NH3B.Cl2C.H2D.O2
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌粉加入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B. 氯化铁溶液腐蚀铜线路板:2Fe3++3Cu=2Fe+3Cu2+
C. 氢氧化铝加入醋酸溶液中:Al(OH)3+3H+=Al3++3H2O
D. 氯化钡溶液滴入硫酸氢钠溶液中:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2L氧气所含的O原子数为NA
B. 1mol/L的CaCl2溶液中含有的Cl﹣为2NA
C. 2.4g镁转化为Mg2+时失去的电子数目为0.2NA
D. 标准状况下,2g氦气所含原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
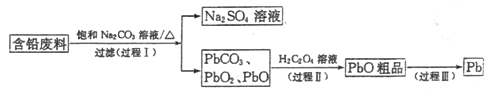
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
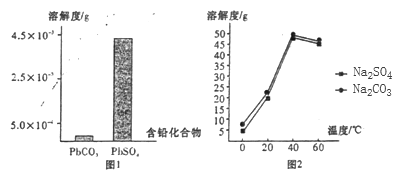
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
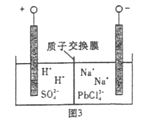
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8===Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是( )

A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-===Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
煤的综合利用是一个重要课题,下图是以煤为原料合成TNT和高聚物F的路线:

请回答下列问题:
(1)下列说法错误的是_______。(填字母代号)
A.煤中含有苯和甲苯,可用分馏的方法把它们分离出来
B.煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气
C.煤是重要能源物质,也是冶金、化学工业的重要原料
D.煤化工是指以煤为原料,经化学加工使煤转化为气体、液体和固体燃料以及化学品的过程
(2)由![]() 生成烃A的反应类型为__________,TNT的核磁共振氢谱有__________个峰。
生成烃A的反应类型为__________,TNT的核磁共振氢谱有__________个峰。
(3)C的名称为_______。
(4)已知E为1,3-丁二烯,D与E以物质的量之比1:1发生聚合反应,且生成的高聚物F为顺式结构,请写出D与E反应的方程式:_____________________;反应③的反应条件为________________。
(5)研究发现,通过上述流程制备高聚物F的产率很低,进一步研究发现,在反应②中生成了大量副产物G,请写出G的结构简式:_______ 。则在G的同分异构体中,含有两个苯环和两个甲基的共有_____________种(不考虑立体异构)。
(6)请写出以CH3COOH、![]() 为原料合成化工产品
为原料合成化工产品 的路线流程图(无机试剂任选)(提示:卤代苯中苯环上的卤原子很难被取代)。_________
的路线流程图(无机试剂任选)(提示:卤代苯中苯环上的卤原子很难被取代)。_________
合成路线流程图示例如下:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com