
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是
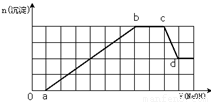
A.d点溶液中含有的溶质只有Na2SO4
B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH—= Mg(OH)2↓
D.原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种
B
【解析】
试题分析:根据图象第一段,沉淀不是马上出现,可知一定有氢离子, H+与HCO3—不能共存,所以无HCO3—。酸碱中和反应是一切反应的优先反应,生成沉淀在后面溶解一部分,一定有铝离子,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含碳酸根离子和镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+;溶液中电荷守恒判断阴离子只能含有SO42-;根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了1体积的氢氧化钠,所以形成氢氧化铝用了3体积的氢氧化钠,还有3体积的氢氧化钠一定是被三价铁离子消耗,原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,中和氢离子用了1体积氢氧化钠,过程中与铵根离子反应有了2体积氢氧化钠,依据图象中 的定量关系计算写出物质的量之比,H+、NH4+、Fe3+、Al3+物质的量之比为1:2:1:1,各段反应:0---a:H++OH-=H2O; a---b:Al3++3OH-=Al(OH)3↓;Fe3++3OH-=Fe(OH)3↓-b---c:NH4++OH- H2O+NH3↑;c---d:Al(OH)3+ OH-=AlO2-+2H2O.A.d点的溶液为Na2SO4和NaAlO2溶液的混合溶液。错误。B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1。正确。C.ab段发生的离子反应为:Al3++3OH-=
Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓。D.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Fe3+。错误。
H2O+NH3↑;c---d:Al(OH)3+ OH-=AlO2-+2H2O.A.d点的溶液为Na2SO4和NaAlO2溶液的混合溶液。错误。B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1。正确。C.ab段发生的离子反应为:Al3++3OH-=
Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓。D.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Fe3+。错误。
考点:考查图像法在混合溶液中离子的鉴定及含量多少的计算中的应用的知识。


科目:高中化学 来源: 题型:
 (2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
(2012?上饶二模)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
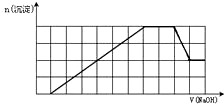 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知查看答案和解析>>
科目:高中化学 来源: 题型:
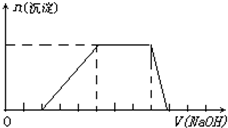 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是查看答案和解析>>
科目:高中化学 来源: 题型:
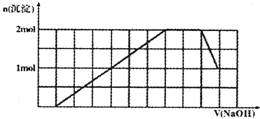 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )| A、原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ | B、原溶液中一定含有SO42-和Na+ | C、原溶液中SO42-的物质的量至少为3.5mol | D、反应最后形成的溶液中含有的溶质为Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
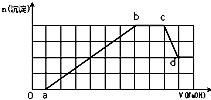 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 | B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com