
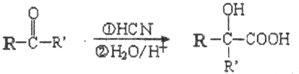 -R、-R′为可能相同或可能不同的原子或原子团
-R、-R′为可能相同或可能不同的原子或原子团 ,X中核磁共振氢谱峰面积比是2:1.
,X中核磁共振氢谱峰面积比是2:1. ,反应类型是加聚反应.
,反应类型是加聚反应.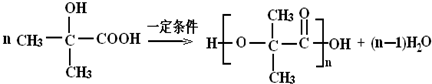 .
.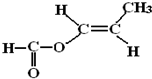 .
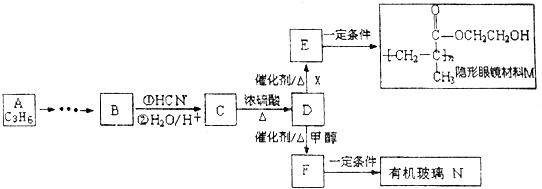
.分析 由A得分子式可知A为CH3CH=CH2,由隐形眼镜材料M的结构简式可知E为CH2=C(CH3)COOCH2CH2OH,则D为CH2=C(CH3)COOH,X应为HOCH2CH2OH,C为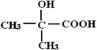 ,由题给信息可知B为
,由题给信息可知B为 ,F为CH2=C(CH3)COOCH3,有机玻璃N为
,F为CH2=C(CH3)COOCH3,有机玻璃N为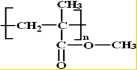 ,据此解答.
,据此解答.
解答 解:由A得分子式可知A为CH3CH=CH2,由隐形眼镜材料M的结构简式可知E为CH2=C(CH3)COOCH2CH2OH,则D为CH2=C(CH3)COOH,X应为HOCH2CH2OH,C为 ,由题给信息可知B为
,由题给信息可知B为 ,F为CH2=C(CH3)COOCH3,有机玻璃N为
,F为CH2=C(CH3)COOCH3,有机玻璃N为 .
.
(1)由以上分析可知A为CH3CH=CH2,名称为丙烯,B为 ,X为HOCH2CH2OH,X中核磁共振氢谱峰面积比是2:1,
,X为HOCH2CH2OH,X中核磁共振氢谱峰面积比是2:1,
故答案为:丙烯; ;2:1;
;2:1;
(2)F为CH2=C(CH3)COOCH3,发生加聚反应生成有机玻璃N为 ,反应的方程式为
,反应的方程式为 ,
,
故答案为: ;加聚反应;
;加聚反应;
(3)C为 ,含有羧基和羟基,可发生缩聚反应,反应方程式为:
,含有羧基和羟基,可发生缩聚反应,反应方程式为: ,
,
故答案为: ;
;
(4)D为CH2=C(CH3)COOH,对应的同分异构体符合:①能发生银镜反应,说明含有醛基,②能与NaOH溶液反应,说明含有羧基或酯基,则为甲酸酯,对应的同分异构体有HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)=CH2以及 ,其中HCOOCH=CHCH3存在顺、反异构,共5种,其中反式结构为
,其中HCOOCH=CHCH3存在顺、反异构,共5种,其中反式结构为 ,故答案为:5;
,故答案为:5; ;
;
(5)M中羟基具有亲水性,且有支链,透气性好,可以作隐形眼镜材料,
故答案为:羟基具有亲水性,且有支链,透气性好.
点评 本体考查有机物的推断,综合考查学生的分析能力、推断能力和综合运用化学知识的能力,关键是熟练掌握官能团的结构、性质以及官能团之间的相互转化.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:多选题
| A. | 观察比较外观形态 | B. | 用手触摸比较 | ||
| C. | 放到嘴里品尝一下 | D. | 用化学方法进行鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 有机物所发生的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
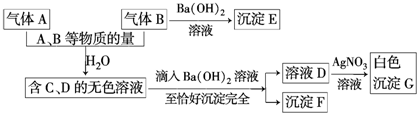
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2COOH | B. | CH3CH(OH)COOH | C. | CH3OCH2COOH | D. | CH3CH(OH)CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定有分子碰撞 | B. | 化学反应的活化能一定大于零 | ||
| C. | 具有较高能量的分子是活化分子 | D. | 发生有效碰撞的分子是活化分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com