
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
① 甲硅烷(SiH4)固态时属于__________ 晶体。
② 已知室温下1g甲硅烷自燃生成SiO2和液态水放出热量44.6kJ,则其热化学方程式为____________。
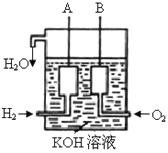
(2)美国阿波罗宇宙飞船上使用了一种新型电池装置,其构造如下图所示,A、B两个电极均由多孔的炭块组成。该电池的负极反应式为:_____________________。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为__________。
(3)化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是____________。
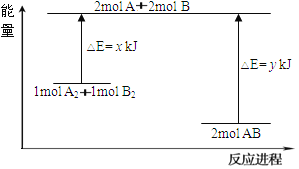
A. 该反应是吸热反应
B. 断裂1mol A-A键和1mol B-B键放出x kJ的能量
C. 断裂2mol A-B键需要吸收y kJ的能量
D. 2mol AB的总能量高于1mol A2和1mol B2的总能量
【答案】分子 SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol H2 - 2 e- + 2 OH-=2H2O 2mol C
【解析】
(1)根据甲硅烷的物理性质分析判断;根据1g甲硅烷燃烧放出的热量计算1mol甲硅烷燃烧放出的热量,进而书写热化学方程式;
(2)在燃料电池中,通入氧气的一极为正极,通入燃料的电极为负极,碱性环境下,氢气反应生成水,据此书写电极反应式,并根据总反应计算;
(3)由图象可知,反应物的能量高于生成物的能量,结合化学键的断裂需要吸收能量分析判断。
(1)①SiH4在常温下为气体,应为分子晶体,故答案为:分子;
②1g甲硅烷的物质的量为![]() =
=![]() mol,放出44.6kJ的热量,则1mol甲硅烷完全燃烧放出的热量为44.6kJ×32=1427.2kJ,热化学方程式为SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol,故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol;
mol,放出44.6kJ的热量,则1mol甲硅烷完全燃烧放出的热量为44.6kJ×32=1427.2kJ,热化学方程式为SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol,故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol;
(2)氢气、氧气和氢氧化钾溶液构成了原电池,总反应方程式为:2H2+O2=2H2O,其中通入氢气的电极为负极,通入氧气的电极为正极,负极上氢气失去电子发生氧化反应,电极反应式为H2-2e-+ 2OH-=2H2O;根据2H2+O2=2H2O知,若该电池工作时增加了1molH2O,电路中转移电子为2mol,故答案为:H2-2e-+2OH-=2H2O;2mol;
(3)A、根据图象,反应物的能量高于生成物的能量时,反应是放热反应,故A错误;B、化学键的断裂吸收能量,而不是释放能量,故B错误;C、化学键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故C正确;D、由图可知,2molAB的总能量低于1molA2和1molB2的总能量,故D错误;故选C。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业采用高温分解H2S制取氢气,2H2S(g) ![]() 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
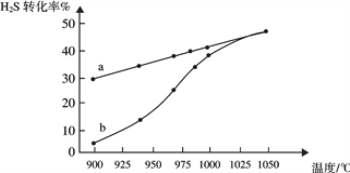
①反应2H2S(g) ![]() 2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =___________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是___________。
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
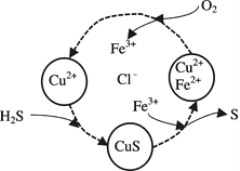
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________。
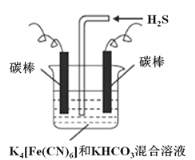
(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___________。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案的设计或描述及对应的离子方程式正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B. 将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
C. 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2+ + 2HCO3- +2OH-=CaCO3↓+CO32-+2H2O
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质发生化学反应时不一定都伴随着能量变化
B. 伴有能量变化的变化都是化学变化
C. 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同
D. 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示装置进行铁与水蒸气反应的实验探究。实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色。请回答:

(1)仪器C的名称为_________________________________________。
(2)该同学据实验得出结论:铁与水蒸气反应生成FeO和H2。该结论不严密,理由是_________。
(3)经检验,反应生成的固体具有磁性,写出铁与水蒸气反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日燃放的五彩缤纷的烟花与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀盐酸清洗做焰色试验的铂丝(或铁丝)
C.焰色试验均应透过蓝色钴玻璃观察
D.焰色试验可区分NaCl与Na2CO3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com