
 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:分析 (1)n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,反应中O元素的化合价由0价降低为-2价,以此计算转移电子的物质的量;
(2)①反应物总能量大于生成物总能量,为放热反应;E为正反应的活化能;
②方程式为2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3,根据1g二氧化硫完全反应生成气态三氧化硫,产生的热量为1.536kJ,可计算反应热;
③将2.0molSO2和1mol O2置于10L恒容密闭反应器中进行反应,则起始浓度分别为0.2mol/L、0.1mol/L,
④SO2、O2、SO3气体平衡浓度都比原来增大,如体积不变,可加入反应物或生成物,也可缩小容器的体积.
解答 解:(1)n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,反应中O元素的化合价由0价降低为-2价,则转移的电子的物质的量为0.5mol×2×2=2mol,故答案为:2mol;
(2)①反应物总能量大于生成物总能量,为放热反应,由图可知E为正反应的活化能,故答案为:放热;正反应的活化能;
②已知1g 二氧化硫完全反应生成气态三氧化硫,产生的热量为1.536kJ,则n(SO2)=$\frac{1}{64}$mol,方程式为2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3,则2mol参加反应放出能量为1.536×2×64KJ=196.6KJ,所以反应热为-196.6KJ/mol,
故答案为:-196.6KJ/mol;
③T℃下,将2.0molSO2和1.0mol O2置于10L恒容密闭反应器中进行反应.第4min时,测得SO2的浓度为0.04mol/L,可知剩余0.4molSO2,即消耗1.6molSO2,则前4min内消耗0.8molO2,v(O2)=$\frac{\frac{0.8mol}{10L}}{4min}$=0.02mol/(L•min),反应达平衡时,SO2的平衡转化率为80%,则
2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3,
起始(mol/L) 0.2 0.1 0
转化(mol/L) 0.16 0.08 0.16
平衡(mol/L) 0.04 0.02 0.16
K=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.02}$=800,
故答案为:0.02mol/(L•min);800;
④A.保持温度和容器的容积不变,充入2molHe,浓度不变,平衡不一定,故A错误;
B.保持温度和容器的容积不变,充入2molSO3,平衡逆向移动,各物质的浓度都增大,故B正确;
C.保持温度和容器的容积不变,充入0.5 mol SO2 和0.25 mol O2,反应物浓度增大,平衡正向移动,达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大,故C正确;
D.保持温度和容器内压强小变,应增大体积,充入lmol SO3,浓度不一定增大,故D错误;
E.缩小容器的容积以增大压强,可在达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大,故E正确.
故答案为:BCE.
点评 本题综合考查化学平衡的计算,为高频考点,侧重考查学生的分析能力、计算能力,注意把握对反应热与焓变的理解,把握化学平衡的计算,难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
 脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )
脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )| A. | 脱落酸在一定条件下能和乙酸发生酯化反应 | |
| B. | 脱落酸分子中含有4个甲基 | |
| C. | 等量脱落酸与足量的NaHCO3、Na反应,放出CO2与H2的物质的量之比为n(CO2):n(H2)=2:1 | |
| D. | 脱落酸能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>W>X>Y | |
| B. | W、X形成的化合物中一定含有离子键 | |
| C. | 最简单氢化物的还原性:Z>W | |
| D. | 工业上常用电解熔融氯化物的方法制备X、Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )
常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后c(A2-)=c(HA-) | |
| D. | pH=4.0时,HA-电离常数为10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 为该转化过程的催化剂
为该转化过程的催化剂查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCnH2n-2(n≥2)中所含的共用电子对数为(3n+l)NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子 转移的数目为5NA | |
| C. | 60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 5.8 g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
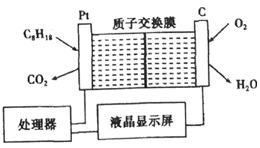 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com