
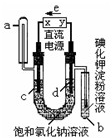
 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )| A. | 在电解开始时,a管中有无色气体生成 | |
| B. | x极为阴性 | |
| C. | 在电解开始后,在c极附近颜色变红 | |
| D. | 通电一段时间后,混合液颜色可能变浅 |
分析 电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,说明d极生成氯气将碘置换出来遇淀粉变蓝,则d为阳极,c为阴极,X为负极,Y为正极,据此分析解答.
解答 解:A、电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,说明d极生成氯气将碘置换出来遇淀粉变蓝,则d为阳极,c为阴极,电解开始时反应为Cu2++2e-=Cu,所以开始时a管中没有无色气体生成,故A错误;
B、c为阴极,X为负极,故B错误;
C、电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,说明d极生成氯气将碘置换出来遇淀粉变蓝,则d为阳极,c为阴极,电解开始时反应为Cu2++2e-=Cu,后来溶液中氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,c极附近溶液才会变红色,故C错误;
D、通电一段时间后,d极生成氯气将碘置换出来遇淀粉变蓝,c为阴极,电解开始时反应为Cu2++2e-=Cu,铜离子浓度减小,则混合液颜色可能变浅,故D正确;
故选D.
点评 本题考查了电解原理的分析应用,主要是电极反应电极判断和溶液酸碱性的分析判断,掌握基础是关键,题目难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何气体的体积都约为22.4L | |
| B. | 在标准状况下某气体的体积约为22.4L,则该气体约含有6.02×1023个分子 | |
| C. | 16.0gCuSO4•5H2O溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 标准状况下,22.4LHCl气体溶于1L水中,所得溶液浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
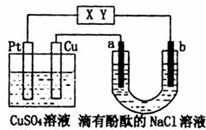
| A. | X极是电源负极,Y极是电源正极 | |
| B. | Pt极上有6.4gCu析出时,b极产生2.24L(标准状况)气体 | |
| C. | a极的电极反应式为:2C1--2e-═C12↑ | |
| D. | 电解过程中 CuSO4溶液的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 mL | B. | 6.75 mL | C. | 4.5 mL | D. | 3 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/LH2SO4溶液 | |
| B. | 5mL 0.1mol/L Na2S2O3溶液和5mL 0.1mol/LH2SO4溶液 | |
| C. | 5mL 0.1mol/L Na2S2O3溶液和5mL 0.05mol/LH2SO4溶液 | |
| D. | 10mL 0.5mol/L Na2S2O3溶液和10mL 0.05mol/LH2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的质量比为5:6 | B. | 氧原子的物质的量之比为3:2 | ||
| C. | 所含硫原子的物质的量之比为1:1 | D. | 硫元素的质量比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| B. | 含重金属离子的电镀废液不能随意排放 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | Si3N4是一种新型无机非金属材料,可应用于制造发动机 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na | Cu | Al | Fe | |
| 熔点(℃) | 97.5 | 1083 | 660 | 1535 |
| 沸点(℃) | 883 | 2595 | 2200 | 3000 |
| A. | Cu和Al | B. | Fe和Cu | C. | Fe和Na | D. | Al和Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com