
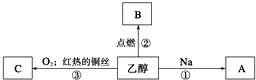
分析 根据题中转化关系,乙醇与氧气在铜作催化剂的条件下被氧化成C为CH3CHO,乙醇与钠反应生成A为CH3CH2ONa,乙醇点燃生成B为CO2,据此答题.
解答 解:根据题中转化关系,乙醇与氧气在铜作催化剂的条件下被氧化成C为CH3CHO,乙醇与钠反应生成A为CH3CH2ONa,乙醇点燃生成B为CO2,反应①的化学方程式为2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑,反应②的化学方程式为CH3CH2OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O,反应③的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑;CH3CH2OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查有机物推断,涉及醇、醛的性质与转化,难度不大,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | C1=C2 | B. | C1>C2 | C. | C1<C2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
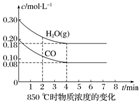 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3<0 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫转化为正交硫是吸热反应 | |
| D. | 质量相等时,单斜硫能量比正交硫能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:空气、矿泉水、水银 | B. | 酸性氧化物:、CO2、SO2、CO | ||
| C. | 盐:醋酸钠、氯化铵、纯碱 | D. | 弱电解质:CH3COOH、H2O、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1(NH4)2SO4溶液:(NH4+)>c(S042-)>c(H+)>(0H-) | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3和NaHCO3等体积混合后的溶液:(Na+)>c(CO32-)>c(HCO3-)>(0H-) | |
| C. | 浓度均为0.1 mol•L-1NH3•H2O和NH4Cl等体积混合后的溶液:c(Cl-)>c(NH4+)>c(NH3•H2O) | |
| D. | 0.1 mol•L-1(Na)2S溶液:(0H-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com