
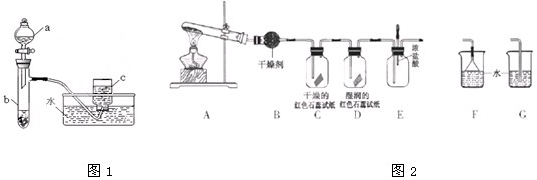
| 3.2g |
| 64g/mol |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、(NH4)2SO4,NH4Cl,NaNO3,Na2S |
| B、Na2CO3,NaHCO3,NH4Cl,NaCl |
| C、Na2CO3,NaHCO3,NaCl,NH4Cl |
| D、NH4Cl,(NH4)2SO4,Na2S,NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
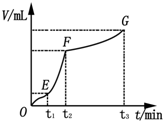 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol?L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和 5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
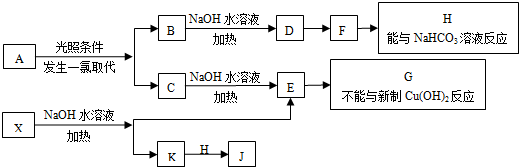
查看答案和解析>>
科目:高中化学 来源: 题型:
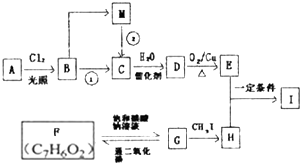
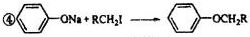
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com