
利用海水制备部分物质的流程图如下。下列有关说法正确的是

A.电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用
B.联合制碱法最终副产物为氯化铵,原子利用率小于100%
C.步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁
D.海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
化学式为C4H10O的醇,能被氧化,但氧化产物不是醛,则该醇的结构简式是( )
A.C(CH3)3OH B.CH3CH2CH(OH)CH3
C.CH3CH2CH2CH2OH D.CH3CH(CH3)CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
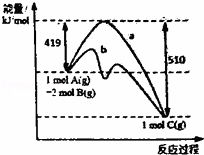
|
| A. | 该反应是吸热反应 |
|
| B. | 催化剂改变了该反应的焓变 |
|
| C. | 催化剂降低了该反应的活化能 |
|
| D. | 该反应的焓变△H=﹣510kJ.mo1﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
|
| A. | c1:c2=1:3 |
|
| B. | N2、H2的转化率不相等 |
|
| C. | 平衡时,H2和NH3的生成速率之比为3:2 |
|
| D. | c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨的反应为N2(g)+3H2(g)⇌2NH3(g).设t℃在容积为2L的密闭容器中充入0.6mol N2和1.6mol H2,反应在一定条件下达到平衡时,NH3的物质的量分数为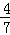 .计算:
.计算:
(1)达到平衡时H2的物质的量;
(2)t℃该反应的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示。加热聚丙烯废塑料得到的产物如下表所示:
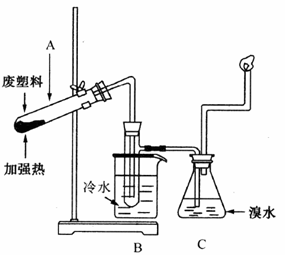
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 炭 |
| 质量分数(%) | 12 | 24 | 12 | 16[ | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
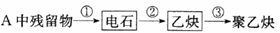
写出反应②、③的化学方程式_____________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有_________种。
(3) 锥形瓶C中观察到的现象是___________,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为___________。
(4) 写出C中逸出的气体在工业上的两种用途_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 H2(g)+I2(g)⇌2HI(g)的平衡常数K1;反应HI(g)⇌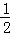 H2(g)+
H2(g)+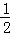 I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)( )
I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)( )
|
| A. | K1=2K2 | B. | K1=K22 | C. | K1= | D. | K1= |
查看答案和解析>>
科目:高中化学 来源: 题型:
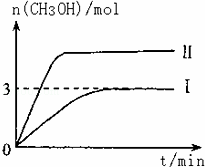
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
( )
|
| A. | 曲线II对应的条件改变是减小压强 |
|
| B. | 若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
|
| C. | 在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
|
| D. | 在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com