
【题目】现有下列物质:①高锰酸钾 ②镁 ③氧气 ④氢氧化钠 ⑤硫酸 ⑥甲烷 ⑦![]() 胶体 ⑧硫酸铜
胶体 ⑧硫酸铜
(1)以上物质属于电解质的是_________,属于非电解质的是_______。(填序号)
(2)属于有机物的是__________。(填序号)
(3)鉴别胶体和溶液最简单有效的物理方法是_____;分离胶体和溶液常用的物理方法是_____。
(4)从上述物质中选出一种或两种为反应物,按下列反应类型各写一个反应化学方程式:
①化合反应:______;
②分解反应:______;
③置换反应:______;
④复分解反应:________。
【答案】①④⑤⑧ ⑥ ⑥ 丁达尔效应 渗析 ![]() (答案合理即可)
(答案合理即可) ![]() (答案合理即可)
(答案合理即可) ![]() (答案合理即可)
(答案合理即可) ![]() (答案合理即可)
(答案合理即可)
【解析】
(1)在水溶液中或熔融状态下能导电的化合物为电解质,在水溶液中和熔融状态下均不能导电的化合物为非电解质,单质和混合物,既不属于电解质,也不属于非电解质;
(2)含碳元素的化合物为有机物;
(3)丁达尔效应是胶体特有的性质,可用以鉴别胶体和溶液,根据胶体和溶液分散质粒子的大小选择分离方法;
(4)①两种或两种以上的物质反应生成一种物质的反应为化合反应;
②一种物质反应生成两种或两种以上物质的反应为分解反应;
③一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应;
④两种化合物相互交换成分生成另外两种化合物的反应为复分解反应。
(1)在水溶液中或熔融状态下能导电的化合物为电解质,在水溶液中和熔融状态下均不能导电的化合物为非电解质,
①高锰酸钾在水溶液中和熔融状态下均能导电,属于电解质;
②镁是单质,既不属于电解质,也不属于非电解质;
③氧气是单质,既不属于电解质,也不属于非电解质;
④氢氧化钠在水溶液中和熔融状态下均能导电,属于电解质;
⑤硫酸在水溶液中能导电,属于电解质;
⑥甲烷在水溶液中和熔融状态下均不能导电,属于非电解质;
⑦![]() 胶体是混合物,既不属于电解质,也不属于非电解质;
胶体是混合物,既不属于电解质,也不属于非电解质;
⑧硫酸铜在水溶液中和熔融状态下均能导电,属于电解质;
综上所述,以上物质中,属于电解质的是①④⑤⑧,属于非电解质的是⑥,故答案为:①④⑤⑧;⑥;
(2)含碳元素的化合物为有机物,故⑥甲烷是有机物,故答案为:⑥;
(3)丁达尔效应是胶体特有的性质,则鉴别胶体和溶液最简单有效的物理方法是丁达尔效应,胶体不能透过半透膜,溶液可以透过半透膜,利用半透膜可以分离胶体和溶液,操作为渗析,故答案为:丁达尔效应;渗析;
(4)①两种或两种以上的物质反应生成一种物质的反应为化合反应,Mg在O2中燃烧为化合反应,化学方程式为![]() ,故答案为:
,故答案为:![]() (答案合理即可);
(答案合理即可);
②一种物质反应生成两种或两种以上物质的反应为分解反应,故KMnO4分解生成K2MnO4、MnO2和O2为分解反应,化学方程式为![]() ,故答案为:
,故答案为:![]() (答案合理即可);
(答案合理即可);
③一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应,故Mg和硫酸反应生成MgSO4和氢气的反应为置换反应,化学方程式![]() ,故答案为:
,故答案为:![]() (答案合理即可);
(答案合理即可);
④两种化合物相互交换成分生成另外两种化合物的反应为复分解反应,NaOH和CuSO4反应生成Cu(OH)2沉淀和Na2SO4的反应为复分解反应,化学方程式为![]() ,故答案为:
,故答案为:![]() (答案合理即可)。
(答案合理即可)。


科目:高中化学 来源: 题型:
【题目】科学家预测第114号元素具有良好的力学、光学、电学等性质。下列对114号元素的叙述错误的是( )
A.该元素的位于第7周期第Ⅳ![]() 族,是金属元素
族,是金属元素
B.该元素的主要化合价为+2、+4
C.该元素的最高价氧化物有较强的氧化性
D.该元素的原子半径小于同主族其他元素的原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
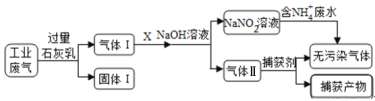
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。

②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。

阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在锂电池发展上做出贡献的三位科学家。某可连续工作的液流锂离子储能电池放电时工作原理如图所示,下列说法正确的是
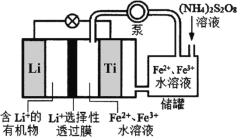
A.放电时,储罐中发生反应:S2O82-+2Fe2+=2Fe3++2SO42-
B.放电时,Li电极发生了还原反应
C.放电时,Ti电极发生的电极方程式为:Fe2+-e=Fe3+
D.Li+选择性透过膜可以通过Li+和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列分析错误的是

A.操作Ⅰ为萃取、分液,萃取剂也可以用选用 CCl4
B.苯酚钠是离子化合物,在苯中的溶解度比在水中的小
C.通过操作Ⅱ,苯可循环使用,三步操作均需要分液漏斗
D.苯酚沾到皮肤上,需用 NaOH 溶液清洗后,再用大量水不断冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag,设计的原电池如图所示。
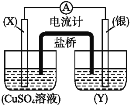
请回答下列问题:
(1)电极X的材料是___;电极X是原电池的___极;
(2)银电极发生的电极反应为___;
(3)今有2H2+O2![]() 2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体![]() 常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为____。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因_____
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作

(3)已知浅蓝色沉淀的成分为![]() ,试写出生成此沉淀的离子反应方程式_________。
,试写出生成此沉淀的离子反应方程式_________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是__。
III.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

(5)A装置中长玻璃管的作用_____,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏低的原因是_______。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物R的结构简式如图所示。下列有关R的性质叙述正确的是( )
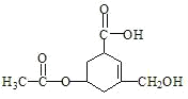
A.R的所有原子一定在同一平面上
B.在Ni催化和加热条件下,lmolR能与3molH2发生加成反应
C.R既能与羧酸、醇反应,还能发生水解、加成和氧化反应
D.1molR与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com