
下列说法或表示方法正确的是 ( )。
| A.反应物的总能量低于生成物的总能量时,反应一定不能自发进行 |
| B.已知:H2S(g)+aO2(g)=x+bH2O(l) ΔH,若ΔH表示H2S的燃烧热,则x为SO2(g) |
| C.已知:2SO2(g)+O2(g)??2SO3(g) ΔH=-98.3 kJ·mol-1,在密闭容器中充入1 mol SO2和0.5 mol O2,充分反应后放出49.15 kJ的热量 |
| D.由石墨比金刚石稳定可得:C(s,金刚石)=C(s,石墨) ΔH>0 |
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是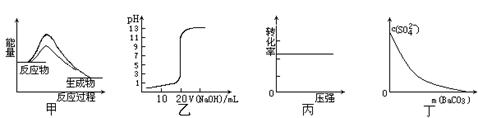
| A.图甲表示使用催化剂后,该反应的ΔH变小 |
| B.图乙表示0.10mol·L-1 NaOH溶液滴定20.00mL0.10mol·L-1 CH3COOH溶液所得到的 滴定曲线 |
C.图丙表示反应H2(g) + I2(g)  2HI(g)中H2的转化率随压强的变化 2HI(g)中H2的转化率随压强的变化 |
| D.图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(SO42-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+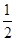 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
| A.△H=+244.1kJ/mol | B.△H=-488.3 kJ/mol |
| C.△H=-996.6 kJ/mol | D.△H=+996.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+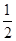 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
| A.② | B.①② | C.①③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式书写正确的是( )
| A.C(s)+O2(g)=CO2(g)ΔH=+393.5 kJ/mol |
| B.2SO+O2=2SO3ΔH=-196.6 kJ/mol |
| C.H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ/mol |
| D.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )。
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,充分燃烧一定量的丁烷,放出热量为
Q kJ(Q>0),经测定完全吸收生成的二氧化碳需要消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+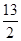 O2(g)=4CO2(g)+5H2O(g)的ΔH为( )
O2(g)=4CO2(g)+5H2O(g)的ΔH为( )
| A.+8Q kJ·mol-1 | B.-8Q kJ·mol-1 |
| C.+16Q kJ·mol-1 | D.-16Q kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是( )。
A.2SO3(g) 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+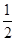 O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+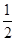 O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com