
| A. | 2,2,7,7-四甲基辛烷的一氯取代物有4种 | |
| B. | 甲醇与分子式为C3H8O的某种有机物相差2个CH2原子团,故它们一定互为同系物 | |
| C. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| D. | 甲烷和 Cl2的反应与乙烯和 Br2的反应属于同一类型的反应 |
分析 A.有机物左右对称,含有3种不同的H;
B.C3H8O的某种有机物可能为醇,也可能为醚;
C.加热50~60℃,苯在浓硫酸作用下,可与浓硝酸发生取代反应;
D.甲烷为饱和烃,发生取代反应,乙烯含有碳碳双键,可发生加成反应.
解答 解:A.2,2,7,7-四甲基辛烷左右对称,含有3种不同的H,则一氯取代物有3种,故A错误;
B.C3H8O的某种有机物可能为醇,也可能为醚,不一定为同系物,故B错误;
C.加热50~60℃,苯在浓硫酸作用下,可与浓硝酸发生取代反应,可生成硝基苯,故C正确;
D.甲烷为饱和烃,可与氯气发生取代反应,乙烯含有碳碳双键,可与溴发生加成反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,侧重考查学生的分析能力,把握常见有机物的结构、官能团、性质及反应类型为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式为SiO2 | B. | 2-丁烯的键线式: | ||
| C. | 丙烷分子的球棍模型示意图: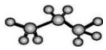 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
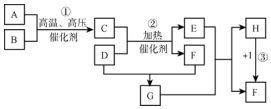
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
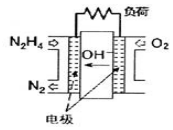 肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.下列说法中,不正确的是( )
肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.下列说法中,不正确的是( )| A. | 该电池放电时,通入肼的一极为负极 | |
| B. | 电池每释放1mol N2转移的电子数为4NA | |
| C. | 通入空气的一极的电极反应式是:O2+4e-+4H+=2H2O | |
| D. | 电池工作一段时间后,电解质溶液的pH将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )
如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )| A. | b为电源的正极,d点周围变红 | B. | Cu电极质量减小,Pt电极质量增大 | ||
| C. | Z中溶液的pH先减小,后增大 | D. | 溶液中的SO42-向Pt电极定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
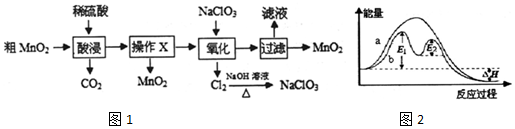
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| D. | 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com