
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1��Ŀǰ��Ӧ����㷺���������������ѳ�������NH3����ԭ������ѧ��Ӧ�ɱ�ʾΪ��2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) ��H��0
�ٸ÷�Ӧ�У���Ӧ��������_____������>������<������=������������������
�ڵ��÷�Ӧ��2mol N2(g)����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ____________mol��
�۸÷�Ӧ�У���ԭ��Ϊ_____________���ѧʽ�������������뻹ԭ�����������Ϊ______________��
��2��Ҳ�������ü������ԭ���������֪��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867kJ/mol
��CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��_________________________________��
��3����������ClO2���������������Ⱦ����Ӧ�������������ַ�Ӧ�����������ȥ����
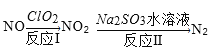
��ӦI�IJ����л�������ǿ�����ɣ�������һ��ǿ��Ϊ���ᣬ��������NO2���ʵ�����ȣ���ѧ��Ӧ����ʽΪ______����Ӧ��������22.4L N2(��״��)��������ClO2______g��
���𰸡� �� 6 NH3 1:1 CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1160kJ��mol��1 2NO + ClO2 + H2O = NO2 + HNO3 + HCl 135
����������1���ٸ÷�Ӧ��H��0���Ƿ��ȷ�Ӧ����Ӧ��������>���������������ڸ÷�ӦNH3(g)��NԪ�ػ��ϼ�Ϊ-3��NO(g)��NԪ�ػ��ϼ�Ϊ+2��NO2(g)��NԪ�ػ��ϼ�Ϊ+4��������N2(g)��NԪ�ػ��ϼ�Ϊ0�����ݻ��ϼ����ߵ���ֵ=���ϼ۽�����ֵ=ת�Ƶ�����������ת�ƹ�ϵΪ��2NH3��6e-���ɻ�ѧ����ʽ�ù�ϵ��2NH3��2N2(g)�����Ե���2molN2(g)����ʱ��ת�Ƶ������ʵ���Ϊ6mol���۸���ǰ��Է�Ӧ��Ԫ�ػ��ϼ۵ķ����ã��÷�Ӧ�У���ԭ��ΪNH3�����������뻹ԭ���ﶼ��N2(g)������Nԭ���غ㼰��ʧ�����غ㣬���������뻹ԭ��������ʵ�����ȣ��������������뻹ԭ����������Ϊ1:1��
��2������֪�е������Ȼ�ѧ����ʽ�ֱ�Ϊ�١��ڣ����ݸ�˹���ɣ�����2-�ٿɵã�CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)��H=-1160kJmol-1��
��3���������̣�һ�������Ͷ������ȷ�Ӧ��NO����ԭ����������ClO2������������ԭ���ٽ����֪��Ϣ�ɵã����������ᡢHCl�Ͷ�����������ѧ����ʽΪ��2NO+ClO2+H2O=NO2+HNO3+HCl�����ݷ�ӦI�ɵã�NO2��ClO2�����ݷ�ӦII��Nԭ���غ�ɵ���2NO2��N2�����2ClO2��2NO2��N2�����Է�Ӧ�������ɱ�״��22.4LN2(��1molN2)��������2molClO2������Ϊ��2mol��67.5gmol-1=135g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.Fe��Ħ��������56g/mol
B.0.1mol/LKCl��Һ�к���0.1molK+
C.1molN2�к��е�ԭ����ԼΪ6.02��1023
D.���³�ѹ�£�1molCO�������22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�������ڻ���ͭ��Ҳ������ʪ����ͭ��ʪ����ͬʱ����ͭ��������������������ҵ��һ�ֹ�������A���������£�
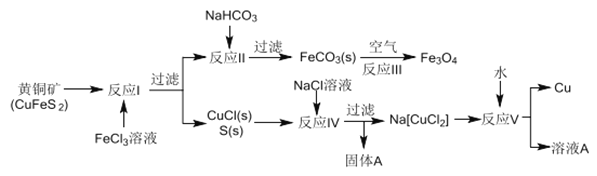
��1����ͭ����Cu �Ļ��ϼ���______����ӦI��65gFeC13 ������________mol CuFeS2��
��2����ҵ�����еĹ��˲��������������������������ʣ������ʺ�������������______��
A�������Ŀ����ϴ� B���������׳��� C�������ʽ�״ D����������״
��3���ڷ�Ӧ���У�����NaHCO3������Һ������CO32-ƽ��Ũ��Ϊ1.2��10-3mol/L���ɲ���FeCO3����ʱ����СFe2+Ũ����_________����֪FeCO3��Ksp��3.0��10-11��
��4����Ӧ�������豸�ײ���������������������շ����Ʊ�������������д����Ӧ�Ļ�ѧ����ʽ_________________��
��5����������A�ijɷ�________��д���ƣ���
��6����ʪ��FeCO3����������ʱ���մ������ڿ�������죬д����صĻ�ѧ����ʽ��_______________��
��7���������п�ʵ��ѭ��ʹ�õ����ʳ���ˮ�⣬����_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽ����������ʵ�һ��ʵ��װ�ã���ش�

��1����XΪ�����������壬YΪ̼������Һʱ���ɹ۲쵽�����ݷų�����ʵ������˵�����������ˮ��Һ����_____�ԡ�
��2����XΪ�����������壬YΪƷ����Һʱ���ɹ۲쵽��������_______����ʵ������˵�����������ˮ��Һ����_______�ԣ���Ӧ���Թ��е���Һ�������һ��ʱ�䣬�ɹ۲쵽��������_______��
��3�����������һ������β����װ�ã����Ż���װ��ͼ��ע����Ҫ��ҩƷ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G��һ��ҽҩ�м��壬�����Ʊ�����Ѫҩ����ͨ������·�ߺϳɣ�
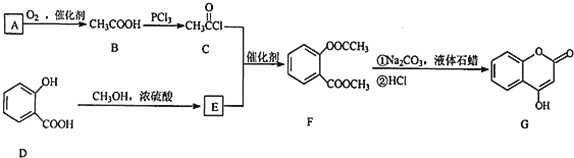
��1��������G�ķ���ʽΪ_________��B����C�ķ�Ӧ����_________��
��2��������D������Ϊ_____________�����ĺ˴Ź�������Ӧ��_______�鲻ͬ���͵ķ壬����̼��������Һ��Ӧ�Ļ�ѧ����ʽΪ��___________________________________��
��3��������E��ͬ���칹���У��ܹ�ʹ�Ȼ�����Һ����ɫ�����ܹ�ˮ�����ɻ�����B����_______�֡����к˴Ź��������������鲻ͬ���͵ķ��ͬ���칹��Ľṹ��ʽΪ___________________________��
��4��д��D��E�ķ�Ӧ��ѧ����ʽ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣�ij�ֺ�������FeCl2���ʵ�FeCl3��Ʒ����Ҫ�ⶨ������Ԫ�صĺ�����ʵ��������²�����У�
��ȷ����m g��Ʒ��2~3g����
������Ʒ�м���10mL 5mol/L�����ᣬ�ټ�������ˮ�����Ƴ�250mL��Һ��
����ȡ25mL����������õ���Һ������3mL��ˮ������ʹ֮��ȫ��Ӧ��
������Ѹ�ټ���Ũ��Ϊ10%�İ�ˮ����������ֽ��裬ʹ֮��ȫ������
�����ˣ�������ϴ�ӡ����ա���ȴ�������������������ء�
���������������ش�
��1��������ǰ��������ƽ��ָ��ƫ��������������ʱ��ָ��պ��ڱ�ߵ��м䣬��������Ʒ������ ��
A����mg�� B����mg�� C��ǡ��Ϊmg
��2���ܽ���ƷʱҪ�������ᣬԭ���� ��
��3������250mL��Һʱ������250mL������ƿ���ձ��⣬�����õ��IJ��������� ��
��4��������ˮʱ������Ӧ�����ӷ���ʽ�� ��
��5������������ΪW1g�����������պ�������������W2 g������Ʒ����Ԫ�ص����������� ��
��6����������250mL��Һʱ�����õ�����ƿû��ϴ�ɾ�����������������ʱ�����ջ�ʹ��Ԫ�صIJⶨ����������ƫ��������ƫ������������������
��NaCl ��Fe2��SO4��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�������õIJ��ֹ�����ͼ��ʾ�������й�˵������ȷ���� )
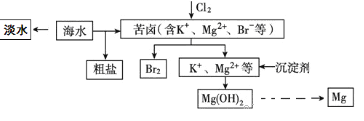
A. ��ˮ�����ķ�����Ҫ�������������������ӽ������ȡ�
B. �����������ǹ�ҵ��ģ��ˮ����ij��÷������乤�յ�����һ�������ǰ�����ͨ���ữ��Ũ����ˮ�����±���С�
C. �ڹ�ҵ��һ��ѡ������������Һ��Ϊͼʾ�еij�������
D. ��Mg(OH)2�����Ƶ�MgCl2��6H2O��ij��ȤС��ͬѧ���������װ����ȡ��ˮMgCl2������װ��A����������ȡ�����HCl���塣
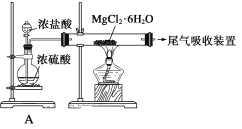
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������ת������ʶ�в���ȷ����
A. ���ˮ��������������ʱ,����ת���ɻ�ѧ��
B. �׳�ƹ���ʱ����ȫ��ת��ɹ���
C. ��ؽ���ѧ��ת��Ϊ����
D. úȼ��ʱ��ѧ����Ҫת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2��8NH3===7N2��12H2O���ɵ�ص�װ����ͼ��ʾ���˷�������ʵ����Ч�������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܡ�����˵����ȷ���ǣ���

A. ���������缫�������غ������Ҳ�缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ2NH3��6e��===N2��6H��
D. ����4.48 L NO2������ʱ��ת�Ƶ�����Ϊ0.8NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com