
在稀硫酸和稀盐酸的混合溶液100mL中,加入固体Ba(OH)24.275g,充分反应后,测得溶液的pH为13(设溶液体积不变),再经过滤得干燥沉淀物2.33g.求原溶液中SO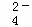 、Cl﹣、H+的物质的量浓度分别是多少?
、Cl﹣、H+的物质的量浓度分别是多少?
考点:
物质的量浓度的相关计算.
专题:
计算题.
分析:
根据充分反应后过滤,得沉淀2.33g为硫酸钡的质量,反应后溶液的pH=13,溶液显示碱性,则氢氧根有剩余,酸完全反应,根据n=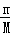 计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算SO42﹣浓度,根据c=
计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算SO42﹣浓度,根据c= 计算SO42﹣的物质的量浓度;
计算SO42﹣的物质的量浓度;
利用n(H+)=n消耗(OH﹣)=2n[Ba(OH)2]﹣n剩余(OH﹣)计算原混酸溶液中氢离子物质的量及浓度,
n(Cl﹣)=(HCl)=n(H+)﹣2n(H2SO4),再根据c= 计算Cl﹣的物质的量浓度.
计算Cl﹣的物质的量浓度.
解答:
解:沉淀2.33g为硫酸钡的质量,则
n(SO42﹣)=n(H2SO4)=n(BaSO4)=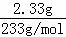 =0.01mol,
=0.01mol,
所以SO42﹣浓度为:c(SO42﹣)= =0.1mol/L;
=0.1mol/L;
反应后的溶液的pH=13,则溶液中OH﹣的物质的量浓度为0.1mol/L,氢氧根离子的物质的量为:0.1L×0.1mol/L=0.01mol,
Ba(OH)2的物质的量为: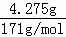 =0.025mol,
=0.025mol,
则酸中总的n(H+)=0.025mol×2﹣0.01mol=0.04mol,
原溶液中氢离子浓度为:c(H+)=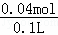 =0.4mol/L,
=0.4mol/L,
n(Cl﹣)=(HCl)=0.04mol﹣2n(H2SO4)=0.04mol﹣2×0.01mol=0.02mol,
则Cl﹣浓度为:c(Cl﹣)=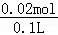 =0.2mol/L,
=0.2mol/L,
答:混合酸溶液中Cl﹣浓度为0.2mol/L,氢离子浓度为0.4mol/L,SO42﹣的物质的量浓度为0.1mol/L.
点评:
本题考查物质的量浓度的计算、离子反应的有关计算等,题目难度中等,注意掌握物质的量浓度的计算方法,明确酸碱中和时离子的关系为解答本题的关键.


科目:高中化学 来源: 题型:
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( )
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于正确的水解离子方程式的是( )
|
| A. | NH4++H2O⇌NH3•H2O+H+ | B. | H2O+H2O⇌H3O++OH﹣ |
|
| C. | CO32﹣+2H2O⇌H2CO3+2OH﹣ | D. | Fe3++3H2O⇌Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)△H,同时符合下列两图中各曲线的规律是( )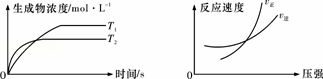
|
| A. | a+b>c+d T1>T2 △H>0 | B. | a+b>c+d T1<T2 △H<0 |
|
| C. | a+b<c+d T1>T2 △H>0 | D. | a+b<c+d T1<T2 △H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写
(1)H2CO3的电离方程式
(2)NaHSO3的电离方程式
(3)NH4Cl水解的离子方程式
(4)向Na2CO3溶液中滴加酚酞呈红色的原因是 (用离子方程式表示); 溶液中各离子浓度由大到小的顺序 ;向此溶液中加入AlCl3溶液,观察到的现象是 ,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时纯水的电离度为α1,pH=2的醋酸溶液中水的电离度为α2,pH=12的氢氧化钠溶液中水的电离度为α3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4。下列关系式中正确的是 ( )。
A.α2=α3<α4<α1 B.α3=α2<α1<α4
C.α2<α3<α1<α4 D.α1<α2<α3<α4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是___________________________________
_______________________________________________________________________________________________________。
(2)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是________mol·L-1。
(3)用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处________(填序号)。上述实验与一定物质的量浓度溶
液配制实验中用到的相同仪器是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是()
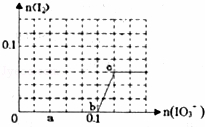
A. 0~b间的反应可用如下离子方程式表示:3HSO3﹣+IO3﹣═3SO42﹣+I﹣+3H+
B. a点时消耗NaHSO3的物质的量为0.12mol
C. 当溶液中I﹣与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D. b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com