
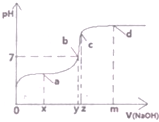
 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.分析 (1)①醋酸与氢氧化钠等物质的量反应生成醋酸钠;醋酸钠溶液中醋酸根离子水解显碱性;
②根据溶液中存在的电荷守恒分析;
③若x=10mL,溶液中的溶质为等物质的量的醋酸和醋酸钠;
④b点所表示的溶液显中性,c(H+)=c(OH-),结合电荷守恒分析;
(2)醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,增大醋酸根离子的浓度平衡逆向移动.
解答 解:(1)①醋酸与氢氧化钠等物质的量反应生成醋酸钠,已知图中c点溶液中只有一种溶质,则该溶质为醋酸钠,即醋酸与氢氧化钠恰好完全反应,二者的浓度相同,所以二者的体积也相同,即消耗20mLNaOH;醋酸钠溶液中醋酸根离子水解显碱性,所以溶液中离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
故答案为:20;c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
②图中a、b、c、d四点所表示的溶液中,存在的离子均为c(Na+)、c(CH3COO-)、c(OH-)、c(H+),溶液中存在的电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
故答案为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
③若x=10mL,溶液中的溶质为等物质的量的醋酸和醋酸钠,则2c(Na+)=c(CH3COO-)+c(CH3COOH);
故答案为:2c(Na+)=c(CH3COO-)+c(CH3COOH);
④b点所表示的溶液显中性,c(H+)=c(OH-),溶液中存在的电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(CH3COO-)=c(Na+);
故答案为:=;
(2)0.1mol•L-1的醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,向溶液中加入少量的醋酸钠固体,醋酸根离子的浓度增大,醋酸的电离平衡逆向移动,抑制了醋酸的电离,使c(H+)减小,故C正确;
故答案为:C.
点评 本题考查了弱电解质的电离、酸碱混合的计算和定性分析,侧重学生分析能力及计算能力的考查,涉及盐类水解、酸碱混合、pH与浓度的关系等,注意电荷守恒和物料守恒的应用,题目难度中等


科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液,c(NH4+)的大小顺序为:①>②>③ | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 0.2mol•L-1HCl与0.1mol•L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | 键能/(kJ•mol-1) | 化学键 | 键能/(kJ•mol-1) |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A. | 氢气的燃烧热为△H=-483kJ/mol | |
| B. | H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=-5kJ/mol | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol | |
| D. | 在相同条件下,等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA | |
| C. | 在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com