
| A、向c(SO42-)=1.05×10-5mol/L的BaSO4溶液中加入BaSO4固体,c(SO42-)增大 |
| B、向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C、向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO42-) |
| D、向该饱和溶液中加入BaCl2固体,则该溶液中c(SO42-)减小 |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
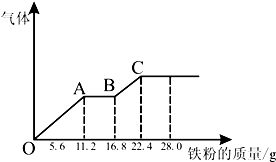 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )| A、H2SO4浓度为4mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、每份混合酸中NO3-物质的量为0.3mol |
| D、第二份溶液中最终溶质为FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3(s) |
| B、Na2SO4溶液 |
| C、KNO3溶液 |
| D、CuSO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
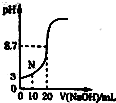 某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图:
某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图:查看答案和解析>>
科目:高中化学 来源: 题型:
A、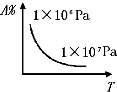 |
B、 |
C、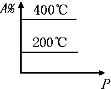 |
D、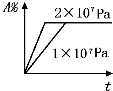 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
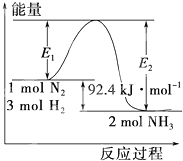 合成氨工业的核心反应是:N2(g)+3H2(g)
合成氨工业的核心反应是:N2(g)+3H2(g)| 催化剂 |
| 高温、高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com