
| A. | 向水中加入少量NH4Cl固体,水的电离程度增大 | |
| B. | 向水中投入金属钾,水的电离平衡向右移动 | |
| C. | 向水中加入浓氨水,c(OH-)增大 | |
| D. | 保持温度不变,向水中加入少量NaOH固体,Kw增大 |
分析 A.含有弱离子的盐促进水电离;
B.K和水反应生成KOH而使溶液呈碱溶液,酸或碱抑制水电离;
C.一水合氨电离程度大于水电离程度,水中加入浓氨水,c(OH-)增大;
D.水的离子积常数只与温度有关.
解答 解:A.含有弱离子的盐促进水电离,氯化铵是强酸弱碱盐,铵根离子水解而促进水电离,故A正确;
B.K和水反应生成KOH而使溶液呈碱溶液,酸或碱抑制水电离,所以KOH抑制水电离,水的电离平衡向左移动,故B错误;
C.一水合氨电离程度大于水电离程度,水中加入浓氨水,导致溶液中c(OH-)增大,但抑制水电离,故C正确;
D.水的离子积常数只与温度有关,温度不变,水的离子积常数不变,故D错误;
故选BD.
点评 本题水的电离及离子积常数,为高频考点,明确水电离影响因素是解本题关键,注意:离子积常数只与温度有关,与溶液酸碱性、溶液浓度无关,为易错题.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| D. | 相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸是强电解质 | |
| B. | 弱电解质在水溶液中一定不能完全电离 | |
| C. | 强电解质的水溶液中不存在分子 | |
| D. | 弱电解质溶液的导电能力一定很弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2mol CO+0.5mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1.5mol CO+0.5mol H2O(g)+0.4mol CO2+0.4mol H2 | |
| C. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青雾中的小水滴颗粒大小约为10-9m~10-7m | |
| B. | 光是一种胶体 | |
| C. | 雾是一种胶体 | |
| D. | 发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | △H>0,m+n>x+y | B. | △H<0,m+n>x+y | C. | △H<0,m+n>x | D. | △H>0,m+n<x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
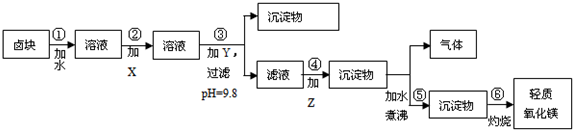
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com