
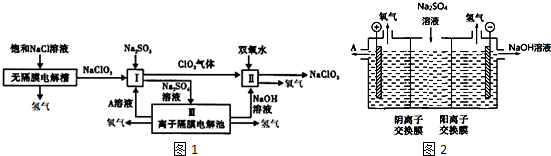
分析 根据工艺流程图用有离子隔膜的电解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以A为硫酸溶液,Ⅰ中氯酸钠、亚硫酸钠和稀硫酸反应生成二氧化氯和硫酸钠,Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气;
(1)根据工艺流程图无隔膜电解槽阳极发生氧化反应生成氯酸根离子;
(2)解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以A为硫酸溶液;
(3)Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气,根据电子得失守恒分析配平;
(4)设备Ⅲ在通电电解前,检验其溶液中主要阴离子是硫酸根离子,SO42-的检验方法:用稀盐酸和氯化钡溶液检验.
解答 解:(1)根据工艺流程图无隔膜电解槽阳极发生氧化反应生成氯酸根离子,所以电极反应式为Cl-+3H2O-6e-=ClO3-+6H+,故答案为:Cl-+3H2O-6e-=ClO3-+6H+; (2)解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以A为硫酸溶液,故答案为:H2SO4;
(3)Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气,所以方程式为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O;
(4)电解前Ⅲ中阴离子为SO42-,SO42-的检验方法:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42-;
故答案为:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42-.
点评 本题以亚氯酸钠(NaClO2)的生产流程为情境,主要考查电解原理、氧化还原反应、离子方程式的书写、SO42-的检验等知识点,主要通过工艺流程考查学生分析问题、解决问题的能力,题目难度中等.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NO(NO2):通过装有水的洗气装置 | |
| B. | Cu粉(铁粉):加足量稀硝酸,过滤 | |
| C. | NH3(H2O):通过装有浓硫酸的洗气装置 | |
| D. | KCl(CaCl2):加适量Na2CO3溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 提高高锰酸钾的氧化能力,用盐酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 检验某氯代烷烃中含氯元素,加碱溶液加热后用稀硝酸酸化,再加硝酸银溶液检验 | |
| D. | 确认某溶液中含有SO42-时,先加入盐酸酸化,再加氯化钡溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究大理石规格(粗、细)对反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 元素周期表共有16个族,也就是16个纵行 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com