
【题目】将10g复盐CuSO4x(NH4)2SO4yH2O加到过量的NaOH溶液中加热,生成的氨气用100mL 0.5mol/L硫酸全部吸收,多余的硫酸用2mol/L NaOH溶液中和,用去NaOH溶液25mL.已知复盐中SO42﹣的质量分数为48%,则x= ,y= .
【答案】1;6
【解析】
试题分析:NaOH中和的硫酸中n(H+)=2molL﹣1×0.025L=0.05mol,
与NH3反应的n(H+)=0.1L×0.5mol/L×2﹣0.05mol=0.05mol,
氨气和氢离子反应方程式为NH3+H+=NH4+,所以根据N原子守恒得n(NH4+)=0.05mol,
复盐中SO42﹣的质量分数为48%,则n(SO42﹣)=![]() =0.05mol,所以该复盐中n(NH4+):n(SO42﹣)=0.05:0.05=1:1,根据铵根离子和硫酸根离子关系计算x值;
=0.05mol,所以该复盐中n(NH4+):n(SO42﹣)=0.05:0.05=1:1,根据铵根离子和硫酸根离子关系计算x值;
根据硫酸根离子的物质的量计算复盐的物质的量,从而确定复盐相对分子质量,根据相对分子质量计算y值.
解:NaOH中和的硫酸中n(H+)=2molL﹣1×0.025L=0.05mol,
与NH3反应的n(H+)=0.1L×0.5mol/L×2﹣0.05mol=0.05mol,
氨气和氢离子反应方程式为NH3+H+=NH4+,所以根据N原子守恒得n(NH4+)=0.05mol,
复盐中SO42﹣的质量分数为48%,则n(SO42﹣)=![]() =0.05mol,所以该复盐中n(NH4+):n(SO42﹣)=0.05:0.05=1:1,根据铵根离子和硫酸根离子关系得1+x=2x,x=1;
=0.05mol,所以该复盐中n(NH4+):n(SO42﹣)=0.05:0.05=1:1,根据铵根离子和硫酸根离子关系得1+x=2x,x=1;
所以其化学式为CuSO4(NH4)2SO4yH2O,每个化学式中含有两个硫酸根离子,10g该复盐含有0.05mol硫酸根离子,所以复盐的物质的量为0.025mol,M[CuSO4(NH4)2SO4yH2O]=![]() =400gmol﹣1,
=400gmol﹣1,
摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为400,所以18y+64+96×2+18×2=400,y=6.
故答案为:1;6.


科目:高中化学 来源: 题型:
【题目】下图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是( )
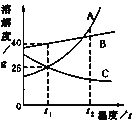
A.t1℃时,B物质的溶解度为40g
B.要将C的不饱和溶液转化为饱和溶液可以采取降温的方法
C.t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C
D.将t2℃时A、B的饱和溶液降温到t1℃时,析出的晶体A比B多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一,它可由下列方法合成:
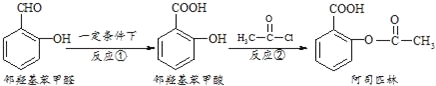
下列说法正确的是( )
A.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3 种
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.邻羟基苯甲醛不能和溴水发生取代反应
D.1mol阿司匹林最多可以和2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铵(NH4)2CO3在室温下就能自发的分解产生氨气,对其说法正确的是( )
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.碳酸铵分解是吸热反应,根据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下防腐措施中,属于电化学保护法的是( )
A.用氧化剂使金属表面生成致密稳定的氧化物保护膜
B.在金属中加入一些铬或者镍制成合金
C.在轮船的船壳水线以下部分,装上一锌锭
D.在金属表面喷漆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的固体混合物分离,最科学的操作顺序是( )
A.溶解、过滤、加热(升华)、蒸发(结晶)
B.加热(升华)、溶解、过滤、蒸发(结晶)
C.加热(升华)、溶解、蒸馏、结晶
D.溶解、结晶、过滤、加热(升华)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
A.4molA+2molB B.1.5molC+0.5molD
C.1molB+1molD D.1molA+0.5molB+1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe和Fe2O3混合物投入2mol/L250mL的HNO3溶液中,反应完全后,无固体剩余,生成2.24L(标准状况)NO气体,再向反应后溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.400mL B.450mL C.500mL D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出下列元素名称:A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: .
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式: .
(4)写出B元素的单质与A元素的最高价氧化物的水化物反应的离子方程式: .
(5)A与氧原子结合的A2B2型化合物的电子式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com