
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
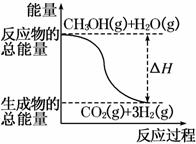 ��CH3OH(g)��H2O(g)===CO2(g)��3H2(g) ��H����49.0 kJ/mol
��CH3OH(g)��H2O(g)===CO2(g)��3H2(g) ��H����49.0 kJ/mol
��CH3OH(g)��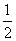 O2(g)===CO2(g)��2H2(g)����H����192.9 kJ/mol
O2(g)===CO2(g)��2H2(g)����H����192.9 kJ/mol
����˵����ȷ���� (����)
A��CH3OH��ȼ����Ϊ192.9 kJ/mol
B����Ӧ���е������仯����ͼ��ʾ
C��CH3OHת���H2�Ĺ���һ��Ҫ��������
D�����ݢ���֪��ӦCH3OH(l)��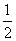 O2(g)===CO2(g)��2H2(g)�Ħ�H����192.9 kJ/mol
O2(g)===CO2(g)��2H2(g)�Ħ�H����192.9 kJ/mol
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����(����)��
A�������Ǵ�ˮ���������ԡ����Ի�����ϡ��Һ���ڳ����£���c(H��)·c(OH��)��1��10��14
B��c(H��)��1��10��7 mol·L��1����Һһ����������Һ
C��0.2 mol·L��1 CH3COOH��Һ�е�c(H��)��0.1 mol·L��1 CH3COOH��Һ�е�c(H��)��2��
D���κ�Ũ�ȵ���Һ��������pH����ʾ�����Ե�ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ���������
A����Ҫ�������Ȳ���ά�ֵĻ�ѧ��Ӧһ�������ȷ�Ӧ
B���кͷ�Ӧ����˵��ˮ���ε�������������ͼ��������
C��C(s) + 1/2O2(g) = CO(g) ��H =��110.5 kJ/mol����ʯī��ȼ����Ϊ
110.5 kJ/mol
D��1 mol/L�����1 mol/L NaOH��Һ�к����ų�������С��1 mol/L�����1 mol/L NaOH��Һ�к����ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1����֪���ظ�������ӣ�Cr2O72�����dzȺ�ɫ�ģ���������ӣ�CrO42-���ǻ�ɫ�ģ��ظ��������ˮ������Ӧ��Cr2O72����H2O 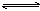 2CrO42����2H������ҺΪ�Ȼ�ɫ������Һ�еμ�������mol/L�����ᣬ��Һ��________ɫ��ԭ����
2CrO42����2H������ҺΪ�Ȼ�ɫ������Һ�еμ�������mol/L�����ᣬ��Һ��________ɫ��ԭ����
��
 ��2����֪��2NO2 N2O4 ��H= -56.9kJ/mol��һ�������£����û����ϵ����һ��������������ɱ���ܱ������У��ƶ������Լ�С�������������ʱ��������________________________________��ԭ����_________________________��
��2����֪��2NO2 N2O4 ��H= -56.9kJ/mol��һ�������£����û����ϵ����һ��������������ɱ���ܱ������У��ƶ������Լ�С�������������ʱ��������________________________________��ԭ����_________________________��
��3����NO2��N2O4����������ں����ܱ������У�������ϵ������100oC����ʱ��������_________________________��ԭ����__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʯī�ͽ��ʯ����̼�ĵ��ʣ�ʯī��һ�������¿�ת��Ϊ���ʯ����֪��ʯī��ȫת��Ϊ���ʯʱ��Ҫ��������������˵����ȷ����( )
A��ʯī������ʯ�ȶ�
B�����ʯ��ʯīһ���ȶ�
C���������Ľ��ʯ��ʯī��ȫȼ�գ��ų�������һ����
D���������Ľ��ʯ��ʯī��ȫȼ�գ�ʯī�ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йػ�ѧƽ�ⳣ��K��˵���У���ȷ����( )
| A��K�Ĵ�С����ʼŨ���й� | B���¶�Խ�ߣ�KֵԽ�� |
| C��KֵԽ��Ӧ���ת����Խ�� | D��KֵԽ������Ӧ���еij̶�ԽС |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£����һ�����ܱ������н������¿��淴Ӧ��
X��g����Y��g�� Z��g����W��s�����ȣ�0����������ȷ����( )
Z��g����W��s�����ȣ�0����������ȷ����( )
A��������������ѹǿ����ʱ����Ӧ�ﵽƽ��
B�������¶ȣ�ƽ�������ƶ�
C�����������ף��淴Ӧ��������
D��ƽ������X��������Ӧ�Ħ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�
SiCl4(g)+2H2(g)=Si(s)+4HCl(g)����H = + Q kJ/mol(Q��0)
ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ����������Ϊ���淴Ӧ��������������ȷ����
A����Ӧ�����У�������ѹǿ�����SiCl4��ת����
B������Ӧ��ʼʱSiCl4Ϊ1 mol�����ƽ��ʱ����������ΪQ kJ
C����Ӧ��4 minʱ����HClŨ��Ϊ0.12 mol/L����H2�ķ�Ӧ����Ϊ0.03 mol/(L��min)
D������Ӧ��������Ϊ0.025Q kJʱ�����ɵ�HClͨ��100 mL 1 mol/L��NaOH��Һǡ�÷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ��������¹ʴ�����ȷ���� �� ��
A������Na�Ż�������ˮ���� B��ʵ����������촵��ƾ���
C��Ƥ���ϲ���մ��NaOH��Һ�������������ϴ
D��ϡ��Ũ����ʱ����Ũ��������������ע��ˮ�У������Ͻ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com