
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
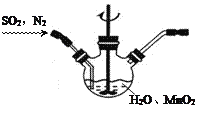
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如右图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2![]() MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
③若用空气代替N2进行实验,会对实验中的SO2利用率_______(选填“增大、无影响、减小”)。
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
【答案】 AB abef 减小 水、盐酸酸化的BaCl2溶液、乙醇 向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色。
【解析】试题分析:(1)①根据影响反应速率的因素分析;②Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理;③氧气能氧化SO2;(2)步骤②为洗涤沉淀、验证洗涤是否干净,根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”分析所需试剂;(3)一种沉淀容易转化为比它更难溶的沉淀;
2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理;③氧气能氧化SO2;(2)步骤②为洗涤沉淀、验证洗涤是否干净,根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”分析所需试剂;(3)一种沉淀容易转化为比它更难溶的沉淀;
解析:(1)①A.MnO2加入前先研磨,增大接触面积,加快反应速率,故A正确; B.搅拌加快反应速率,故B正确; C.提高混合气中N2比例,H2SO3浓度降低,反应速率减慢,故C错误;②Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理,所以应选择的装置有abef;③氧气能氧化SO2,所以空气代替N2进行实验,实验中的SO2利用率减小;(2)根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”,先用蒸馏水洗涤,用盐酸酸化的BaCl2溶液验证洗涤是否干净,再用乙醇洗涤,所以所需试剂是水、盐酸酸化的BaCl2溶液、乙醇;(3)向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3) < KSP(NiCO3)。
2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理,所以应选择的装置有abef;③氧气能氧化SO2,所以空气代替N2进行实验,实验中的SO2利用率减小;(2)根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”,先用蒸馏水洗涤,用盐酸酸化的BaCl2溶液验证洗涤是否干净,再用乙醇洗涤,所以所需试剂是水、盐酸酸化的BaCl2溶液、乙醇;(3)向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3) < KSP(NiCO3)。


科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的溶液,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).

(2)容量瓶上需标有以下6项中的______(填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
(3)容量瓶不能______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(4)在配制过程中,下列操作中能引起误差偏高的有______(填代号).
①未等稀释后的溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。甲组同学采用如右图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4 g铜。

(1)仪器a的名称是_______。
(2)在铜与硝酸的反应中,硝酸所表现出的化学性质主要有_______。
(3)仪器c中收集的气体主要是_______。(填分子式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
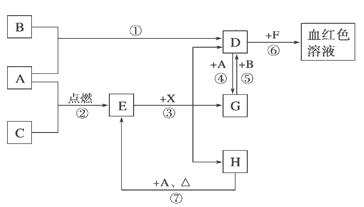
(1)写出下列物质的化学式:D X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;该反应中每消耗0.3mol的A,可转移电子 mol。
(6)除去D溶液中混有的少量G的方法是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫
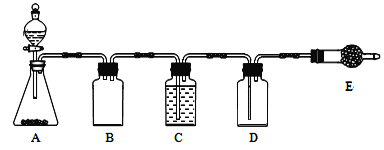
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为
______________________________________________________。
②B装置的作用是_______________________;C装置的试剂为__________________。
③E中固体试剂为________________。
(2)制备保险粉(略)
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O,称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
①滴定时KMnO4溶液装在__________________(玻璃仪器)中。
②滴定终点的标志_______________________________________________________。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为____________(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,恒定的容器中进行下列反应:N2O42NO2,若N2O4的浓度由0.1mol/L降到0.07mol/L要用10s,那么N2O4的浓度从0.07mol/L降到0.04mol/L时,所用时间( )
A. 等于10s B. 等于5s C. 大于10s D. 小于10s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com