
A��B��C��D��E����Ԫ�ص�ԭ��������������,�Ҿ�С��18��Aԭ�ӵ�������Bԭ�ӵ��������2�����ӣ�Aԭ�ӵ������������Ǵ�����������������A��B��C����Ԫ���ܽ�ϳɻ�����C2AB3����1 mol C2AB3�й���52 mol���ӣ�0.5mo1DԪ�صĵ�������ȫ����Ӧʱ����9.03��1023������ת�ƣ���B��D�γɵĻ�������,D����������Ϊ52.94��,Dԭ�Ӻ�����14�����ӣ�ÿ��Eԭ������ԭ�ӻ���ʱֻ������һ�����ۼ�������д���пհף�
��1��Ԫ�ص�����D ,E ��
��2��C��B��ȼ�����ɵĻ�����Ļ�ѧʽ
��3��A��B��C��ϳɵĻ�����Ļ�ѧʽ�� ��
 �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ��ɽ�и߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���̴���������������������ʣ�����ʽΪC27H46O�����̴���һ��������Һ�����ϣ������ʽΪC34H50O2����ϳ����ֵ��̴���������
A��C6H13COOH B��C6H5COOH C��C7H15COOH D��C6H5CH2COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ����ʮУ���н̸Ĺ�ͬ��߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ����
A����0.1 mol NaHSO4������������������������Ϊ0.3NA
B��25��ʱ��pH=13��1.0 LBa(0H)2��Һ�к��е�OH����ĿΪ0.2NA
C�����³�ѹ�£�4.4gCO2��N2O������������е�ԭ����Ϊ0.3 NA
D��1L1 mol��L��1FeCl3��ȫˮ������NA����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ������һ�и߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42-��HCO3�������ӡ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵����ȷ���� �� ��
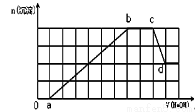
A��ab�η��������ӷ�ӦΪ��Al3++3OH��= Al��OH��3���� Mg2++2OH��= Mg��OH��2��
B��ԭ��Һ�к��е������ӱض���H+��NH4+��Al3+��Mg2+
C��ԭ��Һ�к��е�Fe3+��Al3+�����ʵ���֮��Ϊ1:1
D��d����Һ�к��е�����ֻ��NaAlO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ������һ�и߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ�в���ȷ���ǣ� ��
A��FeBr2��Һ��ͨ������Cl2��2Fe2++Cl2=2Fe3++2Cl-
B�����Ը��������Һ�м�����2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O
C�������������Һ�м���ϡ���2H++S2O32-=S��+SO2��+H2O
D��������ͨ�����Ե⻯����Һ�У�2I-+O2+4H+=I2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ��һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�ȼ����ؿ��������.�����Ĺ�����Դ��һ���ȼ����صĻ����ṹ��ͼ��ʾ��������Ϊ����ʵ���ˮLiCl-KCl������������ں�ؼ���˲��������ܡ��õ���ܷ�ӦΪ��PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb��
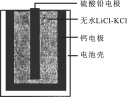
�����й�˵����ȷ����
A ��������Ӧʽ��Ca+2Cl- - 2e- =CaCl2
B���ŵ�����У�Li+���ƶ�
C������ʱ��������������ϵ�����������ƣ�ָ�벻ƫת
D��ÿת��0.1mol���ӣ�����������20.7g Pb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ��һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��W��ԭ��������������X���γɻ�����ܶ��Ԫ�أ���X�������ϼ�Ϊ+1�ͩ�1��Yԭ�������������Ǵ�����3����Z��X����ͬһ���壬W��ԭ��������Y��2����������������ȷ����
A. ԭ�Ӱ뾶�Ĵ�С˳��r(Z)��r(W)��r(Y)��r(X)
B. Ԫ��Y�ļ���̬�⻯������ȶ��Ա�W����
C. ������Z2Y2��X2Y��Ӧʱ��Z2Y2�������������ǻ�ԭ��
D. ��X��Y��Z��W����Ԫ����ɵ����ֻ������ܷ�����ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ�߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
��ҵ����ij����������Cu2O��Al2O3��Fe2O3��SiO2����ȡͭ�IJ�����������:
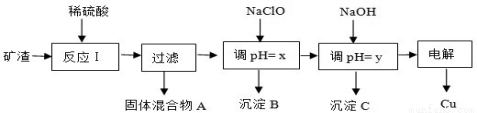
��֪�� Cu2O + 2H+ = Cu + Cu2+ + H2O
������ | Cu��OH��2 | Al��OH��3 | Fe��OH��3 | Fe��OH��2 |
��ʼ����pH | 5.4 | 4.0 | 1.1 | 5.8 |
������ȫpH | 6.7 | 5.2 | 3.2 | 8.8 |
��1����������A�еijɷ��� ��
��2����Ӧ����ɺ���Ԫ�صĴ�����ʽΪ ���������ӷ��ţ���д�����ɸ����ӵ����ӷ���ʽ ��
��3��x��y��Ӧ����ֵ��Χ�ֱ��� �� ��
��4����ⷨ��ȡCuʱ��������ӦʽΪ ��������ӦʽΪ ��
��5�����й���NaClO��pH��˵����ȷ���� ��
a. ����NaClO��ʹ��Һ��pH����
b. NaClO�ܵ���pH����Ҫԭ�������ڷ�����ӦClO��+ H+ HClO�� ClO������H+���Ӷ��ﵽ����pH��Ŀ��
HClO�� ClO������H+���Ӷ��ﵽ����pH��Ŀ��
c .NaClO�ܵ���pH����Ҫԭ��������NaClOˮ��ClO��+ H2O HClO+OH����OH������H+ ���Ӷ��ﵽ����pH��Ŀ��
HClO+OH����OH������H+ ���Ӷ��ﵽ����pH��Ŀ��
��6����NaClO��pH�����ɳ���B��ͬʱ����һ�־���Ư�����õ����ʣ��÷�Ӧ�����ӷ���ʽΪ_________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ��ɽ�и�һ����ĩ�Ŀƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£����鷢���ֽⷴӦ�� C2H6  C2H4+ H2��һ��ʱ������ʵ�Ũ�ȱ��ֲ��䣬��˵��
C2H4+ H2��һ��ʱ������ʵ�Ũ�ȱ��ֲ��䣬��˵��
A����Ӧ��ȫֹͣ
B����Ӧ�ﵽƽ��״̬
C����Ӧ��������ȫ
D������Ӧ���ʴ����淴Ӧ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com