
【题目】为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2 = 2Zn(OH)2,下列说法正确的是

A. 锌块作为原电池的负极,发生还原反应而被腐蚀
B. 海水中的电解质如NaCl起到了导电的作用
C. 正极的电极反应式为:Zn - 2e-=Zn2+
D. 实际应用中,需用锌块覆满船体,完全隔绝海水以防止钢铁被腐蚀
科目:高中化学 来源: 题型:
【题目】化合物Z由如下反应得到:C4H9Br![]() Y
Y![]() Z,Z的结构简式不可能是( )
Z,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.CH2BrCBr(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:

(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是______________________________。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须_______________________。在溶液B中加入适量(NH4)2 (SO4)2固体,加热浓缩时,可以得 到(NH4)2Fe(SO4)4·6H2O的原因是________________________________________________。
(3)溶液B中一定含有的阳离子是________________。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为_______________________________。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成溶液A的离子方程式:___________________________________。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,可用作陶瓷和搪瓷的着色剂和红色 玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据2Cu+H2O![]() Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素可用于治疗白癫风等皮肤顽疾,其关键中间体H的合成路线如下:

回答下列问题
(1)D中含氧官能团是____________(填名称)。A→B,B→C均为取代反应,则A的结构简式为__________________;B→C生成无机产物是_________________________。
(2)花椒毒素比Ⅰ多1个CH2,则花椒毒素的分子式为____________________。
(3)H→G反应的化学方程式为______________________________(只写1个)。
(4)芳香化合物W是D的同分异构体,W苯环上只有3个取代基且W含有2个酚羟基和羧基的结构共有______种,其中核磁共振氢谱为五组峰的结构简式为__________________________。
(5)参照上述合成路线,以苯酚和ClCH2COOH为原料(无机试剂任选),设计制备 的合成路线:_______________________________________________。 (合成路线流程图示例:
的合成路线:_______________________________________________。 (合成路线流程图示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系,下列说法正确的是

A. 最高价氧化物对应水化物酸性: Y>W>T
B. 气态氢化物的稳定性: W>X
C. 单质还原性:T>Z
D. Z、T、W的最高价氧化物对应水化物可以相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有的原子核内都有质子和中子
B.(H+)实质上是一个裸露的质子
C.核外电子排布相同的微粒,其化学性质也相同
D.非金属元素原子最外层电子数都大于4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除工业尾气中的二氧化硫气体对物质的充分利用和环境保护有重要意义。
(1)某温度下,二氧化硫溶于水后所得溶液中H2SO3、HSO3-和SO32-占三种粒子总数的比例随pH 的变化如图所示。则在pH 为3时,溶液中H2SO3、HSO3-和SO32-的浓度最大的为_____。该温度下H2SO3 的电离平衡常数Ka1=_________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收空气中含有的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O![]() H2NCOONH4 (氨基甲酸铵)。
H2NCOONH4 (氨基甲酸铵)。
①当该反应处于平衡状态时,下列措施中有利于提高尿素水解程度的是____(填字母)。
a.升高反应温度 b.延长反应时间
c.增大尿素的浓度 d.向装置中充入SO2和空气混合物
②氨基甲酸铵会与空气中的SO2和O2反应:2 H2NCOONH4 (aq)+2SO2(g)+2O2(g)+H2O![]() 2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
a.SO2和CO2浓度相等 b. SO2百分含量保持不变
c.容器中气体的压强不变 d.CO2的生成速率与SO2的消耗速率相等
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图所示。尿素溶液吸收空气中的SO2后溶液的pH 会降低,为提高SO2 的吸收率和充分回收产物,应控制溶液pH 为_____。
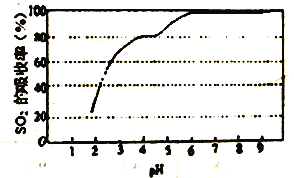
(3)工业上也常用氨水吸收SO2 。25℃时将SO2通入氨水中,当产物恰好为NH4HSO3时,溶液为_____ (填酸性、中性或碱性)。当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=__________。己知25℃,NH3·H2O 的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com