
分析 2min末已生成2mol W,则v(W)=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/l/(L•min),反应速率之比等于化学计量数之比即n:2=v(z):v(w)=0.5:0.5,n=2,
2X(g)+Y (g)?2 Z (g)+2W (g)
起始(mol) 8 4 0 0
转化(mol) 2 1 2 2
平衡(mol) 6 3 2 2
以此解答该题.
解答 解:2min末已生成2mol W,则v(W)=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/l/(L•min),反应速率之比等于化学计量数之比即n:2=v(z):v(w)=0.5:0.5,n=2,
2X(g)+Y (g)?2 Z (g)+2W (g)
起始(mol) 8 4 0 0
转化(mol) 2 1 2 2
平衡(mol) 6 3 2 2
(1)前2min内v(X)=v(Z)0.5mol•(L•min)-1,
答:前2min内用X的浓度变化表示的平均反应速率为0.5 mol/(L•min);
(2)2min末时Y的浓度为$\frac{3mol}{2L}$=1.5mol/L,
答:2min末时Y的浓度为1.5 mol/L;
(3)由以上分析可知化学反应方程式中n值为2,
故答案为:化学反应方程式中n值为2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法计算、速率、浓度的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
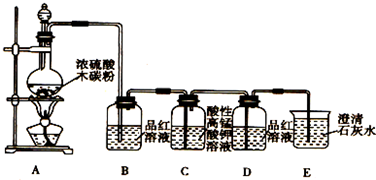
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
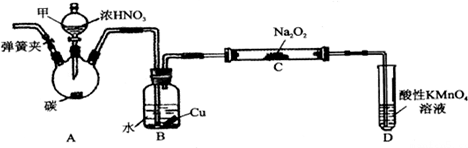
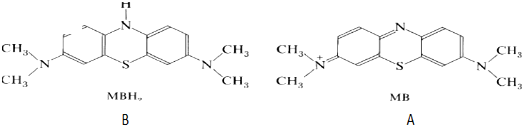
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
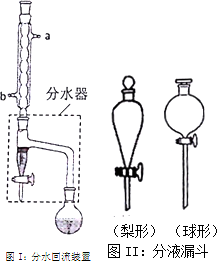 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com