
јЧґјКЗТ»ЦЦРВРНµДЖыіµ¶ЇБ¦ИјБПЈ¬№¤ТµЙПїЙНЁ№эCOєНH2»ЇєПЦЖ±ёјЧґјЈ¬ёГ·ґУ¦µДИИ»ЇС§·ЅіМКЅОЄЈє
CO (g) + 2H2(g)  CH3OH (g) ЎчH 1 ЈЁ·ґУ¦1Ј©
CH3OH (g) ЎчH 1 ЈЁ·ґУ¦1Ј©
ёГ·ґУ¦µДФБПCOєНH2±ѕЙн¶јїЙЧчОЄИјБПМṩ¶ЇБ¦Ј¬ТСЦЄХвБЅЦЦОпЦКИјЙХµДИИ»ЇС§·ЅіМКЅОЄЈє ЎчH2=Ј283 kJЎ¤mol-1 ЈЁ·ґУ¦2Ј©
ЎчH2=Ј283 kJЎ¤mol-1 ЈЁ·ґУ¦2Ј© ЎчH3=Ј242 kJЎ¤mol-1 ЈЁ·ґУ¦3Ј©
ЎчH3=Ј242 kJЎ¤mol-1 ЈЁ·ґУ¦3Ј©
ДіР©»ЇС§јьµДјьДЬКэѕЭИзПВ±нЈє
| »ЇС§јь | CЈC | CЈH | HЈH | CЈO | C O O | HЈO |
| јьДЬЈЇkJЎ¤mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
 O2(g) ="=" CO2(g)Ј«2H2O(g) ЎчH4
O2(g) ="=" CO2(g)Ј«2H2O(g) ЎчH4 O2(g) ="=" CO2(g)Ј«2H2O(l)ЎЈЖ乤ЧчФАнКѕТвНјИзПВЈє
O2(g) ="=" CO2(g)Ј«2H2O(l)ЎЈЖ乤ЧчФАнКѕТвНјИзПВЈє
ЈЁ1Ј©Ј116 kJЎ¤mol-1 ЈЁ2·ЦЈ©
ЈЁ2Ј©Ј651 kJЎ¤mol-1 ЈЁ2·ЦЈ©
µҐО»Ме»э№©ДЬ¶аЈ»ГЬ¶ИґуТЧУЪФЛКдЈ»µҐО»ІъДЬєДСхБїЅПЙЩ
ЈЁ2·ЦЈ¬ЖдЛьєПАнґр°ёѕщёш·ЦЈ©
ЈЁ3Ј© ЈЁ1·ЦЈ©
ЈЁ1·ЦЈ©
ЅµµНОВ¶ИЈ»ФцјУ·ґУ¦ЖшМеµДС№Б¦Ј»Ѕ«·ґУ¦ЙъіЙµДјЧґјј°К±АдДэґУ·ґУ¦МеПµЦРТЖИҐЎЈ
ЈЁ3·ЦЈ¬ЖдЛьєПАнґр°ёѕщёш·ЦЈ©
ФцјУ·ґУ¦ЖшМеµДС№Б¦Ks*5u ЈЁ1·ЦЈ¬ЖдЛьєПАнґр°ёѕщёш·ЦЈ©
ЈЁ4Ј©ўЩ ИзНјЈє ЈЁ2·ЦЈ©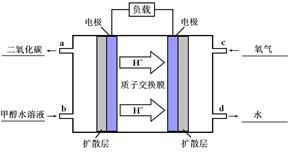
ўЪ 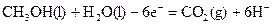 ЈЁ2·ЦЈ©
ЈЁ2·ЦЈ©
ЅвОц


 їОїОБ·ЅЛХПµБРґр°ё
їОїОБ·ЅЛХПµБРґр°ё ГыЕЖЦРС§їОК±ЧчТµПµБРґр°ё
ГыЕЖЦРС§їОК±ЧчТµПµБРґр°ё ГчМмЅМУэїОК±МШСµПµБРґр°ё
ГчМмЅМУэїОК±МШСµПµБРґр°ё ХгЅРВїОіМИэО¬Дї±кІвЖАїОК±МШСµПµБРґр°ё
ХгЅРВїОіМИэО¬Дї±кІвЖАїОК±МШСµПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
| іЈОВ |
| 1 |
| 2 |
| 1 |
| 2 |
| »ЇС§јь | C-C | C-H | H-H | C-O | CЎФO | H-O |
| јьДЬ/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 3 |
| 2 |
| 3 |
| 2 |

Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
| 1 |
| 2 |
| »ЇС§јь | C-C | C-H | H-H | C-O | CЎФOЈЁCOЈ© | H-O |
| јьДЬ/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈєФД¶БАнЅв
| 1 |
| 2 |
| 1 |
| 2 |
| »ЇС§јь | C-C | C-H | H-H | C-O | CЎФO | H-O |
| јьДЬ/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 3 |
| 2 |
| c(CH3OH) |
| c(CO)ЎБc2(H2) |
| c(CH3OH) |
| c(CO)ЎБc2(H2) |
| 3 |
| 2 |

Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2013ЅмХгЅКЎОВЦЭКРК®РЈБЄєПМеёЯИэЙПС§ЖЪЖЪіхїјКФ»ЇС§КФѕнЈЁґшЅвОцЈ© МвРНЈєМоїХМв
ЈЁ12·ЦЈ©јЧґјКЗТ»ЦЦРВРНµДЖыіµ¶ЇБ¦ИјБПЈ¬№¤ТµЙПїЙНЁ№эCOєНH2»ЇєПЦЖ±ёјЧґјЈ¬ёГ·ґУ¦µДИИ»ЇС§·ЅіМКЅОЄЈєCO(g)+2H2(g) CH3OH(g) ЁSH ТСЦЄДіР©»ЇС§јьµДјьДЬКэѕЭИзПВ±нЈє
CH3OH(g) ЁSH ТСЦЄДіР©»ЇС§јьµДјьДЬКэѕЭИзПВ±нЈє
| »ЇС§јь | CЎЄC | CЎЄH | HЎЄH | CЎЄO | CЎФO | HЎЄO |
| јьДЬ/kJЎ¤mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| ·ґУ¦К±јд/min | 0 | 5 | 10 | 15 | 20 | 25 |
| С№Зї/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |

Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2013-2014С§ДкЅОчКЎЖЯРЈёЯИэЙПС§ЖЪµЪТ»ґОБЄїјАнЧЫ»ЇС§КФѕнЈЁЅвОц°жЈ© МвРНЈєМоїХМв
ЈЁўсЈ©јЧґјКЗТ»ЦЦРВРНµДЖыіµ¶ЇБ¦ИјБПЈ¬№¤ТµЙПїЙНЁ№эCOєНH2»ЇєПЦЖ±ёјЧґјЈ¬ёГ·ґУ¦µДИИ»ЇС§·ЅіМКЅОЄЈєCO(g)+2H2(g) CH3OH(g)
ЎчH
CH3OH(g)
ЎчH
ТСЦЄДіР©»ЇС§јьµДјьДЬКэѕЭИзПВ±нЈє
|
»ЇС§јь |
CЎЄC |
CЎЄH |
HЎЄH |
CЎЄO |
CЎФO |
HЎЄO |
|
јьДЬ/kJЎ¤molЈ1 |
348 |
413 |
436 |
358 |
1072 |
463 |
Зл»ШґрПВБРОКМвЈє
ЈЁ1Ј©ТСЦЄCOЦРµДCУлOЦ®јдОЄИюјьБ¬ЅУЈ¬ёГ·ґУ¦µДЎчH= Ј»
ЈЁ2Ј©Ді»ЇС§СРѕїРФС§П°РЎЧйДЈД⹤ҵєПіЙјЧґјµД·ґУ¦Ј¬ФЪИЭ»э№М¶ЁОЄ2LµДГЬ±ХИЭЖчДЪідИл1molCOєН2molH2Ј¬јУИлєПККґЯ»ЇјБЈЁМе»эїЙТФєцВФІ»јЖЈ©єуФЪ250ЎгCїЄКј·ґУ¦Ј¬ІўУГС№Б¦јЖјаІвИЭЖчДЪС№ЗїµД±д»ЇИзПВЈє
|
·ґУ¦К±јд/min |
0 |
5 |
10 |
15 |
20 |
25 |
|
С№Зї/MPa |
12Ј®6 |
10Ј®8 |
9Ј®5 |
8Ј®7 |
8Ј®4 |
8Ј®4 |
ФтґУ·ґУ¦їЄКјµЅ20minК±Ј¬ТФCO±нКѕµДЖЅѕщ·ґУ¦ЛЩВК= Ј¬ёГОВ¶ИПВЖЅєвіЈКэK= Ј¬ИфЙэёЯОВ¶ИФтKЦµ ЈЁМоЎ°ФцґуЎ±ЎўЎ°јхРЎЎ±»тЎ°І»±дЎ±Ј©Ј»
ЈЁ3Ј©ПВБРГиКцЦРДЬЛµГчЙПКц·ґУ¦ТСґпЖЅєвµДКЗ Ј»
AЈ®2v(H2)Хэ=v(CH3OH)Дж
BЈ®ИЭЖчДЪЖшМеµДЖЅѕщД¦¶ыЦКБї±ЈіЦІ»±д
CЈ®ИЭЖчЦРЖшМеµДС№Зї±ЈіЦІ»±д
DЈ®µҐО»К±јдДЪЙъіЙnmolCOµДН¬К±ЙъіЙ2nmolH2
ЈЁўтЈ©»ШґрПВБРОКМвЈє
ЈЁ1Ј©Ме»эѕщОЄ100ml pH=2µДCH3COOHУлТ»ФЄЛбHXЈ¬јУЛ®ПЎКН№эіМЦРpHУлИЬТєМе»эµД№ШПµИзНјЛщКѕЈ¬ФтKa(HX) ______ Ka(CH3COOH)ЈЁМоЈѕЎўЈј»тЈЅЈ©

ЈЁ2Ј©25ЎжК±Ј¬CH3COOHУлCH3COONaµД»мєПИЬТєЈ¬ИфІвµГpH=6Ј¬ФтИЬТєЦРC(CH3COO−)-c(Na+)=____________molЎ¤L-1(Моѕ«И·Цµ)ЎЈ
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com