
【题目】能用分液漏斗分离的混合物是
A. 液溴和四氯化碳B. 甘油和乙酸C. 烧碱溶液和乙醇D. 苯和蒸馏水
科目:高中化学 来源: 题型:
【题目】水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示。
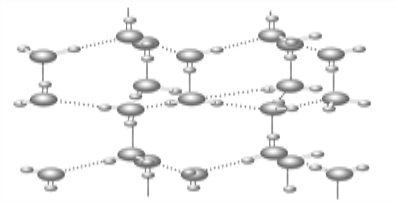
(1)1 mol H2O形成的冰中有________mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为________。
(3)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是________ kJ·mol-1。
(4)氨气极易溶于水的原因之一也是与氢键有关。请判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。

(5)NH3与PH3相比,热稳定性更强的是__________
(6)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是____
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
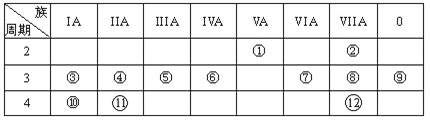
(1)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是____、______。(用元素符号作答)
(2)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式______。
(3)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该化学方程式________。
(4)如何验证元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-=2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( )
A.3
B.4
C.5
D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及预期结果均正确的是( )
选项 | 实验操作 | 预期结果 |
A | 将湿润的NH3通过盛有无水CaCl2的干燥管 | 可得到干燥的NH3 |
B | 将乙烯、乙醇蒸气分别通入酸性KMnO4溶液中 | 两者均能使KMnO4溶液褪色 |
C | Na2O2与湿润的红色试纸接触 | 试纸只变蓝不褪色 |
D | 将CO2通入CaCl2溶液中 | 可得到白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.3kJ,则CH4燃烧的热化学方程式为_____________________。
(2)已知:C(s)+O2(g)=CO2(g);H=﹣437.3 kJ·mol﹣1
H2(g)+![]() O2(g)═H2O(g);H=﹣285.8 kJ·mol﹣1
O2(g)═H2O(g);H=﹣285.8 kJ·mol﹣1
CO(g)+![]() O2(g)═CO2(g);H=﹣283.0 kJ·mol﹣1
O2(g)═CO2(g);H=﹣283.0 kJ·mol﹣1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g) 的焓变H=_______kJ·mol﹣1。
(3)如图所示组成闭合回路,其中甲装置中CH4为负极,O2为正极,稀土金属材料为电极,以KOH溶液为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为400mL。
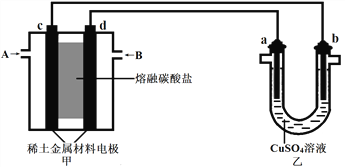
①装置中气体A为_____(填“CH4”或“O2和CO2”),d极上的电极反应式为________。
②乙装置中a极上的电极反应式为_____________。若在a极产生224mL(标准状况)气体,则甲装置中消耗CH4____mL(标准状况),乙装置中所得溶液的pH=___。(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为_____(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最能代表细胞膜基本化学成分的一组化学元素是( )
A. C、H、O、N B. C、H、O、N、P
C. C、H、O、S、P D. C、H、O、Mg、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取CuCl2的生产流程如下:

请结合下表数据,回答下列问题:
物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有________________(填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: _______________________________________ 、
___________________________________________ 。
(3)有浓度均为0.1 molL-1的 ①盐酸 ②硫酸 ③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为____________________;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为_____________。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的Ksp表达式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com