
| 35a |
| 22.4Vρ |
| 1000a |
| 22.4V |
| A、①③ | B、②③ | C、①② | D、只有② |
| 溶质的质量 |
| 溶液的质量 |
| n |
| V |
| 溶质的质量 |
| 溶液的质量 |
| 溶质的质量 |
| 溶液的质量 |
| ||
| ρg/cm3×VmL |
| 17a |
| 22.4ρV |
| n |
| V |
| ||
| V×10-3L |
| 1000a |
| 22.4V |
| 溶质的质量 |
| 溶液的质量 |
| ρ(氨水)Vw |
| ρ(氨水)V+ρ(水)V |
| ρ(氨水) |
| ρ(氨水)+ρ(水) |
| ρ(氨水) |
| ρ(氨水)+ρ(水) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 |
| B、根据溶液的导电能力强弱,将电解质分为电解质、非电解质 |
| C、硫酸钡难溶于水,在水溶液中不能导电,所以硫酸钡不是电解质 |
| D、电解质可按其在水溶液中电离程度不同可分为强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50g46%的乙醇水溶液,含有氢原子总数目为3NA |
| B、实验室配制500ml 0.2mol/L的硫酸亚铁溶液,其操作是用天平称取27.8g绿矾,放入500ml容量瓶中,加水溶解,稀释,定容,摇匀 |
| C、常温下,1L 0.1mol/L的NH4NO3溶液中氧原子数为0.3NA |
| D、1L 0.1mol/L纯碱溶液中含有CO32-的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、容量瓶使用前需要检查是否漏水 |
| C、配置0.1000mol?L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2(SO4)3的酸性溶液中通入足量硫化氢:Fe3++H2S═Fe2++S↓+2H+ |
| B、碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| C、氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| D、澄清石灰水中通入过量CO2:OH-+CO2═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
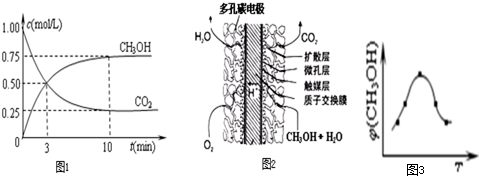
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com