
| A. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| B. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐 | |
| D. | 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚 |
分析 A.HF为弱酸;
B.C与二氧化硅反应生成Si和CO;
C.BaCO3与胃酸反应,可溶性钡离子有毒;
D.氧化铝与NaOH反应.
解答 解:A.HF为弱酸,与二氧化硅反应,则可用于蚀刻玻璃,故A错误;
B.C与二氧化硅反应生成Si和CO,反应中C失去电子,则碳具有还原性,所以一定条件下能将二氧化硅还原为硅,故B正确;
C.BaCO3与胃酸反应,可溶性钡离子有毒,不能作钡餐,而BaSO4难溶于水和盐酸,可用作医疗上的钡餐,故C错误;
D.氧化铝与NaOH反应,则制造熔融烧碱的坩埚应为铁坩埚,故D错误;
故选B.
点评 本题考查物质的性质、用途等,为高频考点,综合考查元素化合物知识,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B>A>C | B. | A>B>C | C. | A>C>B | D. | C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
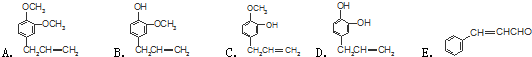
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X,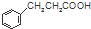 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com