
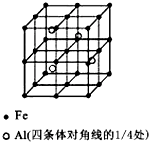
 一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:
一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:分析 ①根据晶胞的结构图可知,铁原子分布在立方体的体心、顶点、棱边的中点、面心,利用均摊法可知晶胞中含有铁原子数为1+$6×\frac{1}{2}+8×\frac{1}{8}+12×\frac{1}{4}$=8,铝原子分布在立方体的体内,数目为4,所以铁原子与铝原子的个数之比为8:4=2:1,据此写出化学式;
②根据密度和晶胞的质量可以求得晶胞的体积,再求得棱长,据此答题.
解答 解:①根据晶胞的结构图可知,铁原子分布在立方体的体心、顶点、棱边的中点、面心,利用均摊法可知晶胞中含有铁原子数为1+$6×\frac{1}{2}+8×\frac{1}{8}+12×\frac{1}{4}$=8,铝原子分布在立方体的体内,数目为4,所以铁原子与铝原子的个数之比为8:4=2:1,据此写出化学式为Fe2Al,
故答案为:Fe2Al;
②根据晶胞的结构图可知,铁原子分布在立方体的体心、顶点、棱边的中点、面心,利用均摊法可知晶胞中含有铁原子数为1+$6×\frac{1}{2}+8×\frac{1}{8}+12×\frac{1}{4}$=8,铝原子分布在立方体的体内,数目为4,设晶胞的边长为a,则晶胞的密度$ρ=\frac{\frac{8×56+4×27}{{N}_{A}}}{{a}^{3}}$,所以a=$\root{3}{\frac{556}{ρN{\;}_{A}}}$cm,
故答案为:$\root{3}{\frac{556}{ρN{\;}_{A}}}$.
点评 本题主要考查了晶胞的计算,难度不大,解题时要注意对均摊法和晶胞密度公式的正确运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为某种燃料电池的工作原理示意图,a、b 均为惰性电极.
如图为某种燃料电池的工作原理示意图,a、b 均为惰性电极.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | a点时溶液的pH=7 | |
| B. | c点时的溶质是(NH3•H2O) | |
| C. | b点时溶液中c(NH4+)>c(NH3•H2O) | |
| D. | a~c段参与反应的离子有H+、OH-、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 四氯化锗与四氯化碳分子都是四面体构型 | |
| C. | 二氧化锗与二氧化碳都是非极性的气体化合物 | |
| D. | 锗和碳都存在具有原子晶体结构的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg电极是该电池的正极 | |
| B. | 电池工作时实现了电能向化学能的转化 | |
| C. | H2O2在石墨电极上发生还原反应 | |
| D. | 电子从石墨电极流向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极,被还原 | B. | 正极,被氧化 | C. | 负极,被还原 | D. | 负极,被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com