
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
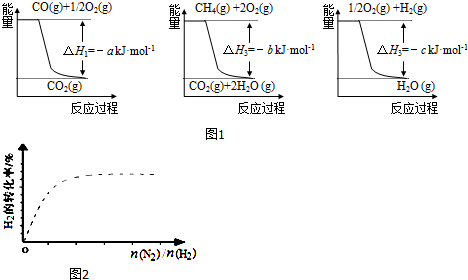
分析 (1)图1中各反应的热化学方程式为:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-akJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bkJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-ckJ/mol
由盖斯定律②-③×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g),焓变也进行相应的计算;
(2)①在2个恒压的密闭容器中,且温度相同,则甲、乙中对应各组分的浓度相等,故反应速率相等;二者为等效平衡,平衡时对应各组分的浓度相同;
②催化剂加快反应速率,缩短到达平衡的时间,不影响平衡移动,氢气的转化率不变,即不使用催化剂到达平衡时间较长.
解答 解:(1)图1中各反应的热化学方程式为:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-akJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bkJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-ckJ/mol
由盖斯定律②-③×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g),故△H4=(a+3c-b)kJ•mol-1,
故答案为:(a+3c-b)kJ•mol-1;
(2)①在2个恒压的密闭容器中,且温度相同,则甲、乙中对应各组分的浓度相等,故反应速率相等,即甲容器达到平衡所需要的时间t=5min;二者为等效平衡,平衡时对应各组分的浓度相同,即乙容器达到平衡时N2的浓度c=3mol•L-1,
故答案为:=;=;
②催化剂加快反应速率,缩短到达平衡的时间,不影响平衡移动,氢气的转化率不变,即不使用催化剂到达平衡时间较长,用实线画出不使用催化剂情况下H2平衡转化率的示意图为: ,
,
故答案为: .
.
点评 本题属于拼合型题目,涉及运用盖斯定律计算反应热、等效平衡、催化剂对平衡移动与化学反应速率的影响等,需要学生具备扎实的基础与分析解决问题能力,难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化剂对H2O2分解速率的影响 | |
| C. | 热稳定性:HF>HC1>HBr>HI | |
| D. | 中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度随着原子序数的增大而增大 | |
| B. | 碱金属单质都是银白色金属 | |
| C. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| D. | 所有气体单质都含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z的电子式是
;Z的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| B. | 试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 | |
| C. | 氢氧化钠沾到皮肤上,先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 | |
| D. | 为了减少实验误差,中和滴定用的锥形瓶必须洗净并烘干后使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维素和油脂都属于天然高分子化合物 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 铁是人体必须的微量元素,所以要多吃含Fe3+的食物 | |
| D. | 生活中常见的酚醛树脂由苯酚和乙醛通过聚合反应得到 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com