
分析 (1)在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,分析反应中元素化合价变化,依据氧化还原反应得失电子守恒结合原子个数守恒配平方程式;
(2)NH3的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,反应生成氮气与水,依据得失电子守恒书写方程式;
解答 解:(1)在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,反应中+1价的氯化合价降为-1价的氯离子,+3价的铁离子化合价升高为高铁酸钠中+6价的铁,要使得失电子守恒则次氯酸钠系数为3,硝酸铁系数为2,依据原子个数守恒,方程式:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
;
故答案为:3;2;10;2;3;6;5H2O;
(2)NH3的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,反应生成氮气与水,化学方程式为:2NH3•H2O+3H2O2=N2↑+8H2O,
故答案为:2NH3•H2O+3H2O2=N2↑+8H2O;
点评 本题考查了离子方程式的书写,准确判断反应中各元素化合价变化是解题关键,注意氧化还原反应得失电子守恒规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
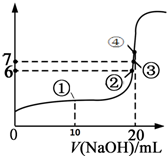 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
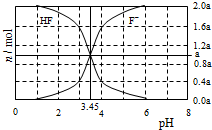 25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是
25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是| A. | pH=3时,溶液中:c(Na+)<c(F一) | |
| B. | c(F一)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol•L-1 | |
| D. | pH=3.45时,NaOH溶液恰好与HF完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
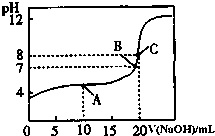 室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);
室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E从HE的溶液中置换出来 | |
| B. | 气态氢化物的稳定性:D>A>B | |
| C. | 离子半径由大到小的顺序是A>J>H | |
| D. | 最高价氧化物的水化物的碱性:H>I>J |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
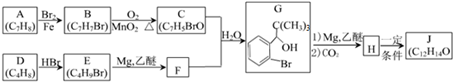
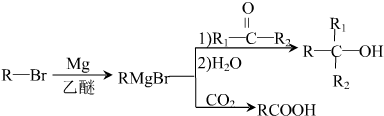
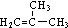 ,D分子中最多有8个原子共平面.
,D分子中最多有8个原子共平面.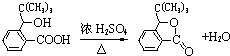 (写明反应条件).
(写明反应条件).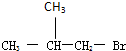 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com