
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

分析 Ⅰ.(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)氢氧化钠要在称量瓶中称量,根据称量固体氢氧化钠所用的仪器来回答;
Ⅱ.(1)NaHCO3溶液与CuSO4溶液生成CuCO3,同时生成二氧化碳、硫酸钠和水;
(2)②为准确测定生成CO2的质量,应防止空气中CO2和水蒸气进入装置;
③为减小实验误差,应先通入过量经NaOH处理的空气,排除装置内的二氧化碳气体,一段时间之后,再进行实验,最后还要通入过量经NaOH处理的空气,使生成的二氧化碳全部被吸收;
④装置D的质量增加的ng为反应生成的二氧化碳的质量,计算二氧化碳的物质的量,根据碳元素守恒可知n(CuCO3)=n(CO2),进而计算沉淀中CuCO3的质量分数.
(3)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数.
解答 解:Ⅰ.(1)没有245mL的容量瓶,所以用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
故答案为:5.0;
(2)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙;
故答案为:a b e;
Ⅱ.(1)NaHCO3溶液与CuSO4溶液生成CuCO3,同时生成二氧化碳、硫酸钠和水,则反应的离子方程式为:Cu2++2HCO3=CuCO3↓+CO2↑+H2O;
故答案为:Cu2++2HCO3=CuCO3↓+CO2↑+H2O;
(2)②为准确测定生成CO2的质量,应防止空气中CO2和水蒸气进入装置;
故答案为:防止空气中CO2和水蒸气进入装置D;
③为减小实验误差,应先通入过量经NaOH处理的空气,排除装置内的二氧化碳气体,即打开K1、K3,关闭K2、K4,通入过量空气,一段时间之后,再关闭K1、K3,打开K2、K4,充分反应,最后还要通入过量经NaOH处理的空气,使生成的二氧化碳全部被吸收,即打开K1、K4,关闭K2、K3,通入过量空气,如若未进行步骤b,将使测量结果偏低;
故答案为:cab;b;
④装置D的质量增加了ng,应为CO2的质量,则m(CuCO3)=$\frac{ng}{44g/mol}$,则沉淀中CuCO3的质量分数为$\frac{\frac{ng}{44g/mol}×124g/mol}{mg}$×100%=$\frac{31n}{11m}$;
故答案为:$\frac{31n}{11m}$;
(3)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数,
故答案为:样品质量和样品充分灼烧后的质量.
点评 本题主要考查学生对溶液的配制,实验原理与装置的理解评价、物质含量的测定、化学计算等知识,题目难度中等,是对所学知识的综合运用,需要学生具备扎实的基础知识与分析问题、解决问题能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 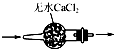 干燥SO2气体 | |
| B. | 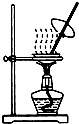 蒸发CH3COONa溶液得醋酸钠晶体 | |
| C. | 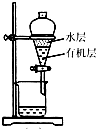 分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 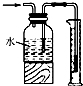 测量氯气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
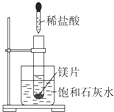 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA | |
| C. | 常温常压下,2 g H2的分子数为NA | |
| D. | 常温常压下,1 mol/L MgCl2溶液中含Cl-数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 晶体硅具有半导体的性质,所以可以制作光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com