
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4L SO3所含的氧原子数目为3NA
科目:高中化学 来源: 题型:
【题目】现有下列化学反应,按要求回答问题:
A.(NH4)2SO3![]() 2NH3↑+H2O+SO2↑ B.2CO+O2
2NH3↑+H2O+SO2↑ B.2CO+O2![]() 2CO2
2CO2
C.2C+SiO2![]() Si+2CO↑ D.NH4NO3
Si+2CO↑ D.NH4NO3![]() N2O+ 2H2O
N2O+ 2H2O
E.CaCO3 + CO2+ H2O=Ca(HCO3)2 F.MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)以上反应中,属于氧化还原反应的是________________(填上述反应的编号);
(2)在反应MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O中:
MnCl2 + Cl2↑+ 2H2O中:
①氧化剂是___________,氧化产物是________。
②在该反应方程式中用双线桥法表示出电子转移的方向和数目_______________。
③若产生了标准状况下3.36L的氯气,则被氧化的HCl的物质的量为________摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的镁-氮二次电池,其装置如图所示,下列说法不正确的是( )
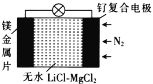
A.固氮时,电池的总反应为3Mg+N2=Mg3N2
B.脱氮时,钌复合电极的电极反应式为Mg3N2-6e-=3Mg2++N2
C.固氮时,外电路中电子由钌复合电极流向镁电极
D.当无水LiCl—MgCl2混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
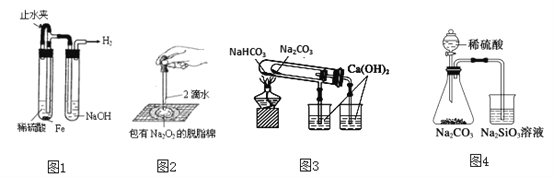
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA
B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA
C.含7.8gNa2S的溶液中阴离子总数大于0.1NA
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 +3Cl2 +10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式__________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:___________。
(4)工业上制漂白粉的化学方程式为_______________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是______。
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_____________________。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
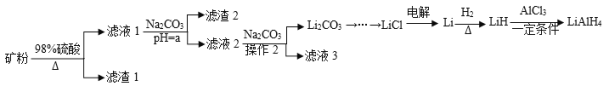
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,等物质的量的N2和CO所含分子数均为NA
B.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
C.常温常压下,lmolNa 加热后生成的Na2O、Na2O2混合物中阴离子数目一定为0.5NA
D.1molFe与足量水蒸气在高温下充分反应后失电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com