
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | H2O |
分析 在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答.
解答 解:A.BeCl2中,Be元素位于第ⅡA族,则2+2=4,则不满足分子中所有原子都满足最外层8电子结构,故A不选;
B.PCl3中,P元素位于第ⅤA族,则5+3=8,满足分子中所有原子都满足最外层8电子结构,故B选;
C.PCl5中,P元素位于第ⅤA族,则5+5=10,则不满足分子中所有原子都满足最外层8电子结构,故C不选;
D.H2O中,H元素最外层最多2个电子,则不满足分子中所有原子都满足最外层8电子结构,故D不选;
故选B.
点评 本题考查原子核外电子数,明确元素的位置、最外层电子数、成键数即可判断,注意规律的应用来解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl- | B. | Fe3+、NH4+、SO42-、NO3- | ||
| C. | Fe2+、Na+、Cl-、ClO- | D. | H+、I-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
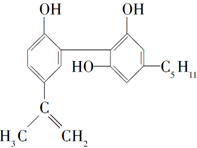 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )| A. | 它的化学式为C19H26O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
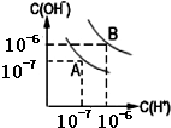 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com