
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,据此解答.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti.
(1)同一周期元素,元素电负性随着原子序数增大而增大,所以这三种元素电负性C<N<O;
E是Ti元素,根据构造原理知Ti的基态原子的电子排布式为1s22s22p63s23p63d24s2,
故答案为:C<N<O;1s22s22p63s23p63d24s2;
(2)由C、O形成的CO32-离子中,根据价层电子对互斥理论知,该离子中价层电子对个数是3且不含孤电子对,所以VSEPR模型名称是平面三角形,中心原子杂化方式为sp2,
故答案为:平面三角形;sp2;
(3)由H、N、O三种元素按照4:2:3的原子个数比可形成某离子化合物为NH4NO3,硝酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度=10-pHmol/L=10-5mol/L,
故答案为:10-5mol/L;
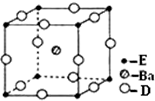
(4)O、Ti和钡三种元素构成的某化合物,根据均摊法知,Ba原子个数是1,O原子个数=12×$\frac{1}{4}$=3,Ti原子个数=8×$\frac{1}{8}$=1,所以其化学式为BaTiO3,
故答案为:BaTiO3;
(5)纳米级的TiO2是一种广泛使用的催化剂,实验室往往通过TiCl4在大量水中加热水解制得TiO2•xH2O,根据反应物、生成物及反应条件知该反应方程式为TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4HCl,
故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4HCl.
点评 本题是对物质结构的考查,推断元素是解题关键,涉及核外电子排布、电负性、价层电子对数互斥理论、杂化方式、盐类水解、晶胞计算等,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
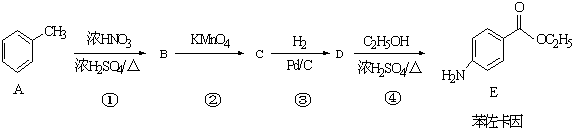
 .
.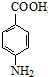 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$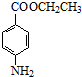 +H2O
+H2O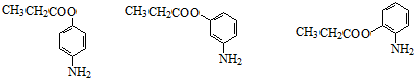 (其中一种)(任写一种)
(其中一种)(任写一种) )的合成路线图(其他原料任选).
)的合成路线图(其他原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
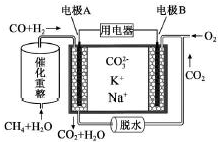
| A. | 正极产物为CO2 | |
| B. | 负极电极反应式为CO-2e-+CO32-═2CO2 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电池总反应式为CO+H2+O2═2CO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
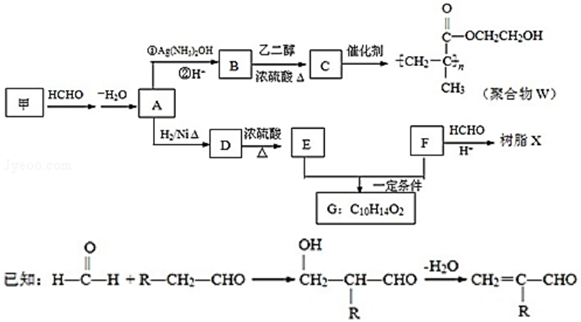
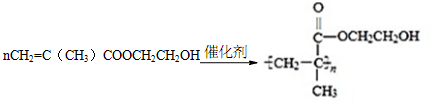 .
.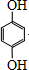
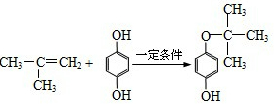 ,反应类型是加成反应.
,反应类型是加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 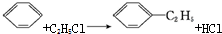 | B. | 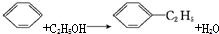 | ||
| C. | 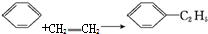 | D. | 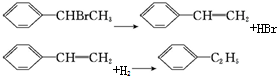 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
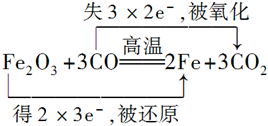 .
.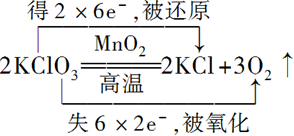 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O>Na2O2 | B. | Na2CO3>NaHCO3>H2CO3 | ||
| C. | Na2SO4•10H2O>Na2CO3•10H2O | D. | NaClO>NaCl>NaF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com