
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
分析 以醇与浓硫酸混合加热制烯烃的反应原理为基础制备环己烯的流程,实验过程包括液体混合物加热、相互混溶液体混合物的分离提纯的基本实验操作,涉及液体混合物加热防暴沸、蒸汽的冷凝及蒸馏操作冷却水的水流方向等操作注意点,另外还探究了影响产率的因素,
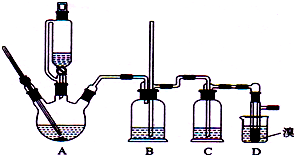
(1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸;
②由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;
(2)①分液后环己烯粗品中还含有少量的酸和环己醇,根据所提供物质的性质分析;
②为了使冷凝的效果更好,冷却水从冷凝管的下口进入,上口出;生石灰能与水反应生成氢氧化钙;
③根据表中数据可知,馏分环己烯的沸点为83℃;
a、若提前收集,产品中混有杂质,实际产量高于理论产量;
b、制取的环己烯物质的量增大,实验制得的环己烯精品质量高于理论产量;
c、粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量;
解答 解:以醇与浓硫酸混合加热制烯烃的反应原理为基础制备环己烯的流程,实验过程包括液体混合物加热、相互混溶液体混合物的分离提纯的基本实验操作,涉及液体混合物加热防暴沸、蒸汽的冷凝及蒸馏操作冷却水的水流方向等操作注意点,另外还探究了影响产率的因素,
(1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,
故答案为:防止液体暴沸;
②由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,
故答案为:冷凝;
(2)①由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用c(Na2CO3溶液)洗涤可除去酸,不能用酸性高锰酸钾,否则会氧化环己烯,
故选:c;
②为了使冷凝的效果更好,冷却水从冷凝管的下口即g口进入;生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;
故答案为:g;除去环己烯中少量的水;
③根据表中数据可知,馏分环己烯的沸点为83℃,故收集产品应控制温度在83℃左右;
a、蒸馏时从70℃开始收集产品,提前收集,产品中混有杂质,实际产量高于理论产量,故a错误;
b、环己醇实际用量多了,制取的环己烯的物质的量增大,实验制得的环己烯精品质量高于理论产量,故b错误;
c、若粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯精品质量低于理论产量,故c正确;,故选c;
故答案为:83℃;c.
点评 本题以有机合成为载体综合考查了实验室制环己烯的知识,考查了学生运用知识的能力,题目难度中等,注意把握实验原理和方法,特别是实验的基本操作,学习中注意积累.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com