
| A. | 质量数为18的氧核素:${\;}_8^{18}$O | B. | 锂离子的结构示意图: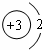 | ||
| C. | 硝基苯的结构简式: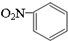 | D. | 四氯化碳的电子式: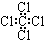 |
分析 A、原子的质量数标在元素符号的左上角;
B、锂离子是锂原子失去一个电子形成的;
C、硝基苯是用硝基取代了苯环上的一个H原子形成的;
D、四氯化碳的电子式中Cl原子电子没有标全.
解答 解:A、原子的质量数标在元素符号的左上角,质子数标在左下角,故质量数为18的氧核素:${\;}_8^{18}$O,故A正确;
B、锂离子是锂原子失去一个电子形成的,故核外有2个电子,则结构示意图为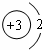 ,故B正确;
,故B正确;
C、硝基苯是用硝基取代了苯环上的一个H原子形成的,且是N原子直接与苯环相连,故结构简式为 ,故C正确;
,故C正确;
D、四氯化碳的电子式中Cl原子周围有8个电子,所以电子没有标全,正确的电子式为 ,故D错误;
,故D错误;
故选D.
点评 本题考查常用化学用语的书写,难度不大,注意D选项中Cl原子周围有8个电子.


科目:高中化学 来源: 题型:选择题
| A. | -44.2kJ•mol-1 | B. | +44.2kJ•mol-1 | C. | -330kJ•mol-1 | D. | +330kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 用加热的方法出去苏打中少量的小苏打 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )
某兴趣小组设计简易原电池装置如图所示,该电池工作时,下列说法正确的是( )| A. | 锌片做正极 | B. | 碳棒上有气泡产生 | ||
| C. | 可将电能转化为化学能 | D. | 电子由碳棒经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品腐蚀时既可作正极也可作负极 | |
| B. | 铁制品腐蚀时铁电极发生反应为:Fe-3e-=Fe2+ | |
| C. | 铁制品腐蚀时或发生析氢腐蚀或发生吸氧腐蚀 | |
| D. | 铁制品连接电源正极可防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
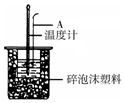
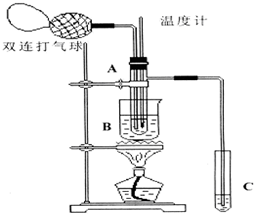 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯在桌上歪倒失火后,立即用湿布盖灭 | |
| B. | 灭火,也用黄沙扑灭 | |
| C. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗 | |
| D. | 不慎将酸溅到眼中,应立即用干布擦去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com