
| 1 |
| 11 |
| 6V |
| 11��22.4 |
| n |
| V |
| 6V | ||
11��22.4��
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | K2SO4��BaCl2��NH4NO3 |
| �� | NaCl��Ca��OH��2��K2CO3 |
| �� | HCl��Na2SO4��NaCl |
| �� | K2SO4��Na NO3��KCl |
| A���� | B���� | C���� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cl-��Ba2+��Mg2+��ClO- |
| B��Cl-��SO42-��Cu2+��Mg2+ |
| C��Cl-��SO42-��K+��Na+ |
| D��HCO3-��NO3-��Na+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
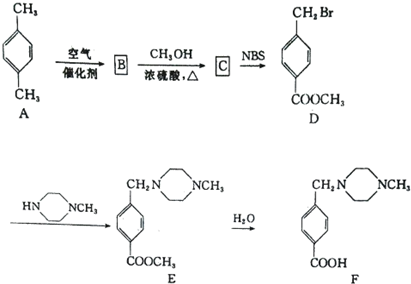
 ����ӦC��D�Ļ�ѧ����ʽΪ
����ӦC��D�Ļ�ѧ����ʽΪ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
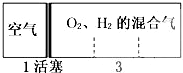
| A���٢� | B���ڢ� | C���ۢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HIO��HCN��Ϊ���м��Լ���ֱ���μ��Է��� |
| B��SiO2��C02��ΪÿĦ����4��6.02��1023�Թ��õ��ӶԵ����������� |
| C��Na2SŨ��Һ��ϡ����ֱ�μӵ�����AgCl��Һ�о�һ���г������� |
| D�����������ӽ�����֬���ܽ���ˮ���е��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��C2H2���� |
| B��C2H4��C8H8 |
| C��CH4��C4H10 |
| D��C2H6��C2H6O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.8��10-5 | K1 4.3��10-7 K2 5.6��10-11 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com