
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
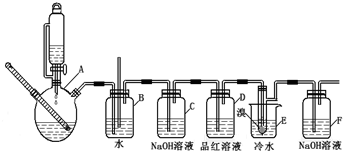
分析 实验室制备1,2-二溴乙烷流程:装置A中:乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,全瓶b可以防止倒吸;当c堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管,装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化硫发生反应,除去乙烯中带出的酸性气体,装置D中品红溶液验证二氧化硫是否被除尽,液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,E装置中:乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用F吸收.
(1)乙醇在浓硫酸作催化剂加热170℃时生成乙烯;
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下;
(3)因浓硫酸的强氧化性A中有部分酸性气体SO2和CO2生成,C中NaOH溶液就是为了吸收这两种酸性气体,避免干扰乙烯与溴的加成反应;
(4)二氧化硫能使品红褪色;
(5)液溴易挥发,冷水冷却,能减少液溴挥发;由表中数据可知温度太低,1,2-二溴乙烷会凝结为固体;
(6)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;
(7)根据尾气的成分是乙烯和溴分析.
解答 解:(1)乙醇在浓硫酸作催化剂加热170℃时生成乙烯,其反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下,所以气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下;
故答案为:使连通滴液漏斗里的溶液容易滴下;
(3)用氢氧化钠溶液吸收SO2和CO2气体发生反应的离子方程式为SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O;
(4)无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全,
故答案为:验证二氧化硫是否被除尽;
(5)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发;由表中数据可知1,2-二溴乙烷的熔点为9℃,如用冰水冷却时温度太低,1,2-二溴乙烷会凝结为固体,从而导致导管堵塞,故答案为:减少液溴挥发;1,2-二溴乙烷易凝结成固体而发生堵塞;
(6)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;故答案为:乙醇挥发、副反应发生或反应太剧烈;
(7)实验中尾气的成分是乙烯和溴,二者都易溶于四氯化碳,所以能用四氯化碳液体吸收多余的气体;故答案为:乙烯和液溴均易溶于四氯化碳.
点评 本题考查了1,2-二溴乙烷实验室制取、乙烯的制取、实验装置的理解评价、化学方程式的书写等,注意基础知识的掌握,本题难度中等


科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:填空题
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题。
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点。以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(3)右图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。

(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3·H2O):c(NH4+)=5:9,此时溶液的pH= .(25℃时,NH3·H2O的电离常数Kb=1.8×10-5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出SiO2溶于氢氟酸的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2 的体积分数是80%
的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
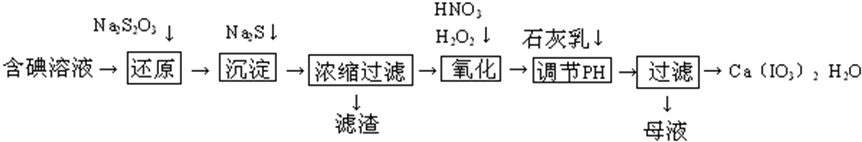
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,若电解5min时,铜电极质量增加2.16g.试回答:
如图所示,若电解5min时,铜电极质量增加2.16g.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com