

| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A、U形管内红色退去 |
| B、试管内溶液变红 |
| C、气球a变瘪 |
| D、U形管水位d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2查看答案和解析>>
科目:高中化学 来源: 题型:
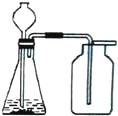
| A、用KMnO4粉末制取O2 |
| B、用浓氨水和CaO制取NH3 |
| C、用Zn和稀硫酸制取H2 |
| D、用石灰石和稀盐酸制取CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 靛蓝是一种食品用合成色素,但对人体有害.使用时必须严格控制使用量.靛蓝允许小于0.1g?kg-1.靛蓝结构简式如图所示.下列关于靛蓝的叙述错误的是( )
靛蓝是一种食品用合成色素,但对人体有害.使用时必须严格控制使用量.靛蓝允许小于0.1g?kg-1.靛蓝结构简式如图所示.下列关于靛蓝的叙述错误的是( )| A、靛蓝可与溴水发生加成反应,使溴水褪色 |
| B、它的分子式是C16H10N2O2 |
| C、该物质分子量较大是高分子化合物 |
| D、它与氢气发生加成反应,1mol靛蓝需氢气最大量是9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Ca2+数目减少 |
| B、Ca2+浓度增大 |
| C、溶液中OH-浓度减小 |
| D、溶液OH-浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com