
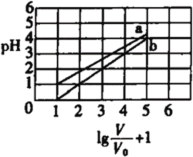
【题目】次磷酸(H3PO2,一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1 mol L-1的H3PO2溶液和1 mol˙L-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示.下列说法错误的是:
A.常温下,该HBF4溶液满足pH=![]()
B.常温下,H3PO2的电离平衡常数约为1.1![]() 10-2
10-2
C.常温下,NaBF4溶液的pH=7
D.NaH2PO2溶液中:c(OH-)-c(H+) =c(H3PO2)
【答案】A
【解析】
当![]() +1=1时,V=V0,即起始时1mol/L的曲线b溶液的pH=0,说明曲线b对应酸为强酸,H3PO2为一元弱酸,则曲线b为氟硼酸(HBF4)加水稀释的曲线,曲线a为H3PO2溶液的稀释曲线,据此分析。
+1=1时,V=V0,即起始时1mol/L的曲线b溶液的pH=0,说明曲线b对应酸为强酸,H3PO2为一元弱酸,则曲线b为氟硼酸(HBF4)加水稀释的曲线,曲线a为H3PO2溶液的稀释曲线,据此分析。
A.根据图示曲线b可知,![]() +1=1,则
+1=1,则![]() =pH=0,
=pH=0,![]() +1=5时,
+1=5时,![]() =pH=4,所以在0pH4时,HBF4溶液满足pH=
=pH=4,所以在0pH4时,HBF4溶液满足pH=![]() ,故A错误;
,故A错误;
B.a曲线表示的是次磷酸的稀释曲线,由曲线上的点的坐标可知,1mol/L的次磷酸溶液的pH=1,即c(H+)=0.1mol/L;次磷酸电离方程式为:H3PO2H+ +H2PO2-,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(H2PO2-)=0.1mol/L,那么次磷酸的电离平衡常数即为:
Ka![]() ,故B正确;
,故B正确;
C.根据图像可知,b表示的酸每稀释十倍,pH值增加1,所以b为强酸的稀释曲线,又因为H3PO2为一元弱酸,所以b对应的酸只能是氟硼酸(HBF4),即氟硼酸为强酸;那么NaBF4即为强酸强碱盐,故溶液为中性,常温下pH=7,C项正确;
D.NaH2PO2溶液中:符合质子守恒,c(OH-)=c(H3PO2)+c(H+),则c(OH-)-c(H+) =c(H3PO2),故D正确;
答案选A。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是
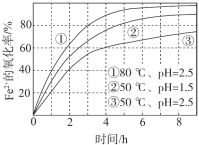
A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
(资料查阅)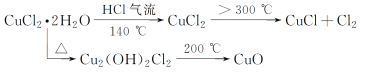
该小组用如图所示装置进行实验(夹持仪器略)
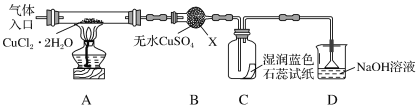
请回答下列问题:
(1)仪器X的名称是___。
(2)实验操作的先后顺序是a→___→e(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是___。
(探究反思)
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息
①若杂质是CuCl2,则产生的原因是___。
②若杂质是CuO,则产生的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应原理和实验装置(加热装置略)如下:![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
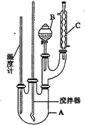
下列有关说法正确的是
A.反应结束后,冷却至室温倒入分液漏斗中。依次用水,5%的NaOH溶液,水洗涤,然后加入CaCl2干燥后,过滤,可得到高纯度的硝基苯。
B.用本套仪器也可以制备溴苯
C.装置C的作用是冷凝回流。其中冷凝水从C的下口流出
D.纯净的硝基苯是无色的,但实验所得硝基苯呈黄色,主要是由于溶解了苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物是重要的材料,应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
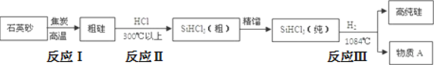
①用石英砂和焦炭高温加热时有碳化硅生成,该反应的化学方程式为______________。
②写出由纯SiHCl3制备高纯硅的化学反应方程式:________________。
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出并配平该化学反应方程式:________________。
(2)水泥属于硅酸盐工业产品,是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
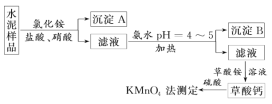
回答下列问题:
①在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_______________,还可使用_________代替硝酸。
②沉淀A的主要成分是__________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为________。
③加氨水过程中加热的目的是_______。沉淀B的主要成分为________、_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之间的转化
实验操作: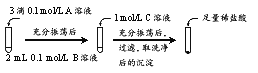
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______。
(2)探究AgCl和AgI之间的转化
实验Ⅲ: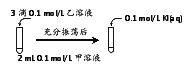
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 | |
| ⅰ.如图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______。
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______。
(3)综合实验Ⅰ~Ⅳ,可得出结论: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2SiHCl3(g)![]() SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
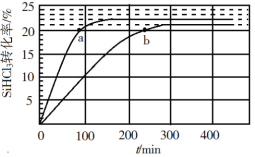
下列说法不正确的是
A.343 K 时反应物的平衡转化率为 22%
B.a、b 处反应速率大小:va>vb
C.要提高 SiHCl3 转化率,可采取的措施是降温和及时移去反应产物
D.已知反应速率![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时 ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com