
| HA | H2B | H2C | H3D |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
分析 弱酸的电离平衡常数越大,弱酸的酸性越强,据电离平衡常数可知酸性H3D>HA>H2B>H2C>H2D->HB->HC->HD2-,据此分析.
解答 解:(1)多元弱酸一级电离生成的氢离子会抑制二级电离,所以多元弱酸的二级电离程度远小于一级电离,
故答案为:多元弱酸一级电离生成的氢离子会抑制二级电离;
(2)弱酸的电离平衡常数越大,弱酸的酸性越强,据电离平衡常数可知酸性H3D>HA>H2B>H2C,故答案为:H3D;H2C;
(3)酸性HA>H2B>HB-,所以向10mL 0.01mol/L Na2B溶液中逐滴加入10mL 0.01mol/L HA溶液,并充分搅拌,反应生成NaHB和NaA,离子方程式为B2-+HA=HB-+A-,
故答案为:B2-+HA=HB-+A-;
(4)将等物质的量的HA、H2B、H2C、NaH2D溶于水配成混合溶液,若逐滴加入烧碱溶液,酸性强的酸首先反应,酸性最弱的最后反应,所以最先与烧碱反应的离子方程式是H3D+OH-=H2O+H2D-,最后与OH-反应的离子是HD2-+OH-=H2O+D3-,故答案为:H3D+OH-=H2O+H2D-;HD2-+OH-=H2O+D3-.
点评 本题考查了据弱酸的电离平衡常数判断弱酸酸性强弱以及强酸制取弱酸的相关知识,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3在水中的溶解度很小,其水溶液电阻率很大,所以CaCO3是弱电解质 | |
| B. | CaCO3在水中溶解度很小,但溶于水的CaCO3全部电离,所以CaCO3是强电解质 | |
| C. | 强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱 | |
| D. | 液态SO2不导电,但溶于水后导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Mg2+,CO${\;}_{3}^{2-}$,SO${\;}_{4}^{2-}$,Na+ | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:K+,SO${\;}_{4}^{2-}$,OH- | |
| C. | 使石蕊试液变蓝色的溶液中:Mg2+,Cl-,K+ | |
| D. | 使酚酞变红的溶液中:Na+,Cl-,SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3晶体 | B. | CH3COONa晶体 | C. | Na2SO4溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
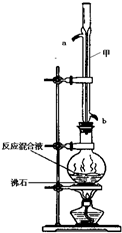 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com