
| A. | 用托盘天平称量11.7g氯化钠晶体 | |
| B. | 用碱式滴定管量取25.00mL高锰酸钾溶液 | |
| C. | 不宜用瓷坩埚灼烧氢氧化钠、碳酸钠 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 | |
| E. | 用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH2COOH溶液 |
分析 A.托盘天平的感量为0.1g;
B.高锰酸钾溶液具有氧化性;
C.瓷坩埚中二氧化硅可与碱、碳酸钠反应;
D.pH试纸不能湿润;
E.稀释时强酸的pH变化大.
解答 解:A.托盘天平的感量为0.1g,可用托盘天平称量11.7g氯化钠晶体,故A正确;
B.高锰酸钾溶液具有氧化性,不能用碱式滴定管量取,故B错误;
C.瓷坩埚中二氧化硅可与碱、碳酸钠反应,不能用瓷坩埚灼烧氢氧化钠、碳酸钠,故C正确;
D.pH试纸不能湿润,否则可能产生误差,故D错误;
E.稀释时强酸的pH变化大,则用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液,故E正确;
故选BD.
点评 本题考查化学实验方案的评价,综合性较强,考查知识点较多,侧重物质的称量、中和滴定、中和热测定等实验的考查,注重基础知识的考查,把握仪器的结构及使用方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.
人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  | 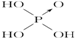 |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,亚砷酸
,亚砷酸 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(k) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2 | |
| B. | 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2 | |
| C. | 由Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 所以Cu+I2$\frac{\underline{\;\;△\;\;}}{\;}$CuI2 | |
| D. | 由钠保存在煤油中,所以钾也可以保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2与水反应,转移电子1mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将0.01mol的Na2O和Na2O2分别投入同质量的水中,所得到的溶质质量分数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com