
(2)试用冰醋酸、电流计、蒸馏水,以及其他仪器设计实验证明醋酸是弱电解质。
(1)①取样,加适量盐酸,试样溶解且产生无色、无味气体,证明它可与比碳酸强的酸反应。HCO![]() +H+====CO2↑+H2O
+H+====CO2↑+H2O
②取样,加入滴有酚酞的适量稀NaOH溶液中,溶液红色变浅,证明它可与NaOH反应。HCO![]() +OH-====
+OH-====![]() +H2O
+H2O
③取样于大试管中,加热,可产生能使澄清石灰水变浑浊的无色气体,同时在试管口处
有无色液体生成,证明它受热可分解。![]()
(2)在500 mL或1000 mL的烧杯中,加入少量冰醋酸,刚好使电极浸没为止,用电极、导线连接电流计。开启电源,观察电流计指针摆动的情况。然后用蒸馏水逐滴地进行稀释,边加蒸馏水边振荡或用玻璃棒搅动。在稀释前指针不动,随着稀释电流计指针摆动越来越大。如果不断稀释,电流计指针摆动又会逐渐减小。其I-V(H2O)图象如图所示。



科目:高中化学 来源: 题型:阅读理解
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
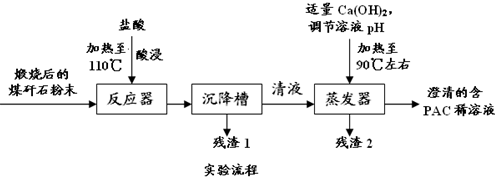
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯,等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能Mg和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
查看答案和解析>>
科目:高中化学 来源:新课标2011届度上学期高三一轮复习单元测试3(新人教) 题型:实验题
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
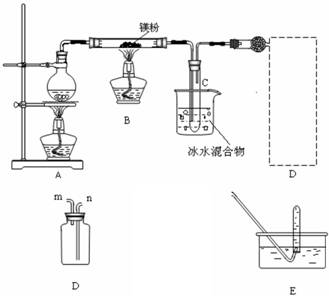
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯,等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能Mg和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
查看答案和解析>>
科目:高中化学 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H2CO3)
②纯碱溶液呈碱性,其原因是(用离子方程式表示) ,
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示) 。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com