
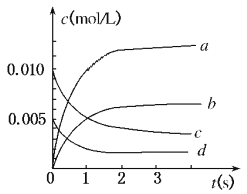
【题目】在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________已知:K300℃>K350℃,则该反应是_______热反应图中表示NO2变化的曲线是__________上述反应在第5s时,NO的转化率为_________。
(2)能说明该反应已达到平衡状态的是__________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
【答案】 ![]() 放 b 65% bc c
放 b 65% bc c
【解析】(1)化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数乘积的比,因此平衡常数为:![]() ;由于K300℃>K350℃,说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应反应是吸热反应,所以正反应是放热反应;由于NO2是生成物,开始时的浓度小,达到平衡时的浓度大,,排除c d。△C(NO)=(0.020-0.007)mol÷2L=0.0065mol/L, △C(NO):△C(NO2)=1:1所以右图中表示NO2的变化的曲线是b;5s时,体系中剩余的NO物质的量为0.007 mol,则反应的NO的物质的量为0.020 mol-0.007 mol=0.013mol,则第5s时,NO的转化率为
;由于K300℃>K350℃,说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应反应是吸热反应,所以正反应是放热反应;由于NO2是生成物,开始时的浓度小,达到平衡时的浓度大,,排除c d。△C(NO)=(0.020-0.007)mol÷2L=0.0065mol/L, △C(NO):△C(NO2)=1:1所以右图中表示NO2的变化的曲线是b;5s时,体系中剩余的NO物质的量为0.007 mol,则反应的NO的物质的量为0.020 mol-0.007 mol=0.013mol,则第5s时,NO的转化率为![]() ; (2) a、在任何时刻都存在v(NO2)=2v(O2),因此不能说明该反应达到平衡状态,故a错误;b.因为该反应是在体积固定的密闭容器中进行的反应前后气体体积不等的可逆反应,如果反应前后气体的物质的量不变,则容器的压强就不变,任何物质的浓度都不发生变化。反应达到了平衡状态。b正确;c、v逆(NO)=2v逆(O2)=2v正(O2),表明正逆反应速率相等,即达平衡状态,故c正确;d、由于容器的容积不变,所以无论是否反应,也无论反应是否达到平衡状态,容器内的气体的密度都不会发生变化。故d错误;故选bc。(3) a、及时分离出NO2气体,反应速率减小,平衡正向移动,错误; b、适当升高温度,反应速率增加,但平衡逆向移动,错误;c、增大O2的浓度,反应速率增大,且平衡向正反应方向移动,故正确; d.选择高效催化剂,平衡不移动,故错误;故选c。
; (2) a、在任何时刻都存在v(NO2)=2v(O2),因此不能说明该反应达到平衡状态,故a错误;b.因为该反应是在体积固定的密闭容器中进行的反应前后气体体积不等的可逆反应,如果反应前后气体的物质的量不变,则容器的压强就不变,任何物质的浓度都不发生变化。反应达到了平衡状态。b正确;c、v逆(NO)=2v逆(O2)=2v正(O2),表明正逆反应速率相等,即达平衡状态,故c正确;d、由于容器的容积不变,所以无论是否反应,也无论反应是否达到平衡状态,容器内的气体的密度都不会发生变化。故d错误;故选bc。(3) a、及时分离出NO2气体,反应速率减小,平衡正向移动,错误; b、适当升高温度,反应速率增加,但平衡逆向移动,错误;c、增大O2的浓度,反应速率增大,且平衡向正反应方向移动,故正确; d.选择高效催化剂,平衡不移动,故错误;故选c。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(s)+Y(g)![]() W(g)+Z(g)(正反应是放热反应),在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是( )
W(g)+Z(g)(正反应是放热反应),在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是( )

A. 增加了X的物质的量 B. 降低了温度
C. 增大了压强 D. 增大了Y的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制备碱式碳酸铜,其制备过程如下:
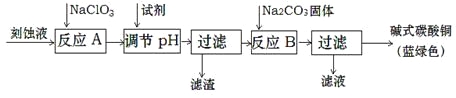
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pAg=-lgc(Ag+),pCl=-lgc(Cl-),根据不同温度下氯化银饱和溶液的pAg和pCl可绘制图像如图所示,且已知氯化银的溶解度随温度的升高而增大,根据该图像,下列表述正确的是

A. A点表示的是T1温度下的不饱和溶液
B. 将A点的溶液降温,可能得到C点的饱和溶液
C. 向B点所表示的溶液中加入氯化钠溶液,溶液可能改变至D点
D. T3>T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器里进行反应,M、N的物质的量随时间的变化曲线如图所示,且两者都为气体:
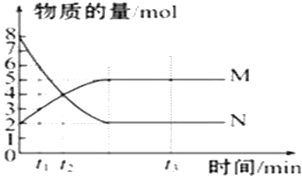
(1)此反应的化学方程式为__________________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:__________________。
(3)达平衡时N的转化率为:_______________ ;
(4)反应前与达平衡时容器内压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
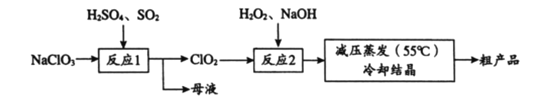
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com