
��15�֣�
1-1 2011���ǹ��ʻ�ѧ�꣬�Ǿ�����˻��ŵ������ѧ��100���ꡣ������˷��ֵ����ֻ�ѧԪ�ص�Ԫ�ط��ź��������Ʒֱ��� �� ��
1-2 ��TiOSO4ˮ��Һ�м���п������Ӧ����Һ��Ϊ��ɫ������ҹ�еμ�������CuCl2ˮ��Һ��������ɫ���������ɰ�ɫ���������ӷ���ʽ�� �������μ�CuCl2ˮ��Һ����ɫ������ʧ�������ӷ���ʽ�� ��
1-3 20����60���άҲ�ɴ�ѧV.Gutmann�о�С�鱨������ԭ�ӷ���A����SF4��NH3��Ӧ�ϳɣ�A��AgF2�����õ��е�ΪΪ27�����Ԫ������B��A��B�����е�����ԭ����ͬ�ֶ�λԭ�ӵĺ˼�༸����ȣ�B������һ���������3�����档����A��B�Ľṹʽ����ȷʾ���������ؼ�������ֽ���ϵļ���Ш�μ���ʾ���Ǽ��ϵ��Ӳ��ر������
1-4 ����Al2(n-C4H9)4H2��Mg[Al(CH3)4]2�Ľṹ��ʽ��
1-5 ��֪EӨ(FeO42��/Fe3+) = 2.20 V��EӨ(FeO42��/Fe(OH)3) = 0.72 V��
�� д�����������Ȼ�����Ӧ�γɸ�����������ӷ���ʽ�� ��
�� д���������������ˮ��Һ�зֽ�����ӷ���ʽ�� ��
�� �ø��������þ����ɼ��Ե�أ�д���õ�صĵ缫��Ӧ ��
��15�֣�
1-1 Ra �� Po ��
1-2 Ti3+ + Cu2+ + Cl�� + H2O = TiO2+ + CuCl��+2H+ CuCl + Cl�� = CuCl2��
1-3 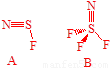
1-4 
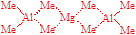
1-5 �� 2Fe3+ + 3Cl2 + 16OH�� = 2FeO42�� + 6Cl�� + 8H2O
�� 4FeO42�� + 20H+ = 4Fe3+ + 3O2 + 10H2O
�� ������FeO42�� + 4H2O + 3e�� = Fe(OH)3 + 5OH��
������Mg + 2OH�� - 2e�� = Mg(OH)2
��������Zn��ǿ��ԭ������TiO2+��ԭ���ͣ�+3����̬�����ͼ�̬Ti�����Ի�ԭ�ԣ���Cu2+��ԭ���Ӷ�����CuCl������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(12��)����A��B��C��D��E���ֶ�����Ԫ�أ���ԭ��������������A��C�Ļ�̬ԭ�ӵ����Ų���δ�ɶԵ�����������������ȣ���A�������������Ǵ�����������2����D�������ӡ�C�������Ӿ�����ԭ�ӵĵ��Ӳ�ṹ��ͬ����D�ĵ�����C�ĵ��ʷ�Ӧ������D2C��D2C2���ֻ����E����������������������������l��
(1)2011���ǹ��ʻ�ѧ�꣬����һ����Ҫ��Ǽ��������˻�ŵ������ѧ��100���ꡣ��������˷���I����(Ra)����(Po)Ԫ�أ�����E����ͬ���壬��λ�� �塣
(2)E�Ļ�̬ԭ�ӵĺ�������Ų�ʽ�� ��A��B��C����Ԫ���е�һ������������ ��B��c��D��ԭ�Ӱ뾶��С�����˳��Ϊ (����Ԫ�ط��� ��ʾ)��
(3)D2C2��AC2��Ӧ�Ļ�ѧ����ʽΪ ����д���÷�Ӧ��һ���� ��
(4)B����Ԫ���γ������̬�⻯��Ŀռ乹��Ϊ �����й��ۼ�����Ϊ (��Լ���Ǽ��Լ�)����֪B��B����Ϊ946 kJ��mol-1��H-H����Ϊ
436 kJ��mol-1��B��H����Ϊ391 kJ��mol-1����B2��H2��Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��15�֣�
1-1 2011���ǹ��ʻ�ѧ�꣬�Ǿ�����˻��ŵ������ѧ��100���ꡣ������˷��ֵ����ֻ�ѧԪ�ص�Ԫ�ط��ź��������Ʒֱ��� �� ��
1-2 ��TiOSO4ˮ��Һ�м���п������Ӧ����Һ��Ϊ��ɫ������ҹ�еμ�������CuCl2ˮ��Һ��������ɫ���������ɰ�ɫ���������ӷ���ʽ�� �������μ�CuCl2ˮ��Һ����ɫ������ʧ�������ӷ���ʽ�� ��
1-3 20����60���άҲ�ɴ�ѧV.Gutmann�о�С�鱨������ԭ�ӷ���A����SF4��NH3��Ӧ�ϳɣ�A��AgF2�����õ��е�ΪΪ27�����Ԫ������B��A��B�����е�����ԭ����ͬ�ֶ�λԭ�ӵĺ˼�༸����ȣ�B������һ���������3�����档����A��B�Ľṹʽ����ȷʾ���������ؼ�������ֽ���ϵļ���Ш�μ���ʾ���Ǽ��ϵ��Ӳ��ر������
1-4 ����Al2(n-C4H9)4H2��Mg[Al(CH3)4]2�Ľṹ��ʽ��
1-5 ��֪EӨ(FeO42��/Fe3+) = 2.20V��EӨ(FeO42��/Fe(OH)3) =0.72 V��
�� д�����������Ȼ�����Ӧ�γɸ�����������ӷ���ʽ�� ��
�� д���������������ˮ��Һ�зֽ�����ӷ���ʽ�� ��
�� �ø��������þ����ɼ��Ե�أ�д���õ�صĵ缫��Ӧ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�갲��ʡ���������꼶��һ�ν�ѧ������鿼�Ի�ѧ�Ծ��������棩 ���ͣ������
(12��)����A��B��C��D��E���ֶ�����Ԫ�أ���ԭ��������������A��C�Ļ�̬ԭ�ӵ����Ų���δ�ɶԵ�����������������ȣ���A�������������Ǵ�����������2����D�������ӡ�C�������Ӿ�����ԭ�ӵĵ��Ӳ�ṹ��ͬ����D�ĵ�����C�ĵ��ʷ�Ӧ������D2C��D2C2���ֻ����E����������������������������l��
(1)2011���ǹ��ʻ�ѧ�꣬����һ����Ҫ��Ǽ��������˻�ŵ������ѧ��100���ꡣ��������˷���I����(Ra)����(Po)Ԫ�أ�����E����ͬ���壬��λ�� �塣
(2)E�Ļ�̬ԭ�ӵĺ�������Ų�ʽ�� ��A��B��C����Ԫ���е�һ������������ ��B��c��D��ԭ�Ӱ뾶��С�����˳��Ϊ (����Ԫ�ط��� ��ʾ)��
(3)D2C2��AC2��Ӧ�Ļ�ѧ����ʽΪ ����д���÷�Ӧ��һ���� ��
(4)B����Ԫ���γ������̬�⻯��Ŀռ乹��Ϊ �����й��ۼ�����Ϊ (��Լ���Ǽ��Լ�)����֪B��B����Ϊ946 kJ��mol-1��H-H����Ϊ
436 kJ��mol-1��B��H����Ϊ391 kJ��mol-1����B2��H2��Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com