
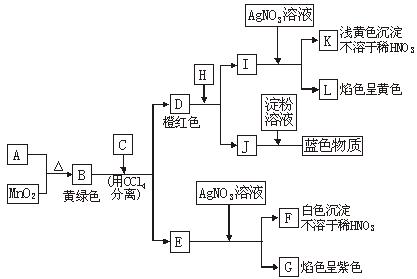
A.________,B.________,C.________,D.________,E.________,F.________,
G.________,H.________,I.________,J.________,K.________,L.________。
科目:高中化学 来源: 题型:阅读理解
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | |
1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | V (Na2CO3)/mL | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 |
| 3 | 2.0 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 |
| 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 40 | 多、蓝色 |
| 2 | 60 | 少、浅绿色 |
| 3 | 75 | 较多、绿色 |
| 4 | 80 | 较多、绿色(少量褐色) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(a)A (b)B (c)C (d)D

(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是_______________。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是_______________ (填名称),可以验证该结论的实验是_______________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
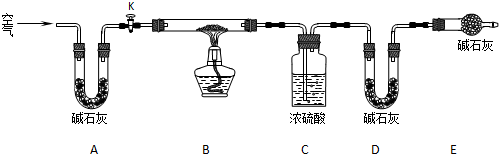
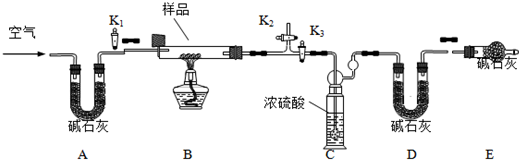
例某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示的装置先进行了有关实验:
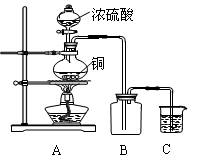
⑴B是用来收集实验中产生的装置,但未将导管画全,请将装置图补充完整。
⑵实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜与浓硫酸反应的化学方程式
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是 。
③下列试剂中能够证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为了测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
①甲同学设计方案是:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有很多种,请问下列实验方案中不可行的是 (填写字母编号)
A:将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B:将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称量沉淀
C:用排水法测定装置A产生气体的体积(已折算成标准状况)
D:将装置A产生的气体缓缓通入足量的氢氧化钡溶液(预先除去了溶解O2),反应完全后,过滤、洗涤、干燥,称量沉淀(隔绝空气条件下)
②乙同学设计的方案是:
在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴加2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测定出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液体积不变,你认为乙同学设计的实验方案能否求得余酸的物质的量浓度 ,(填能或否),其理由是 。
(4)请你再设计一个可行的实验方案来测定余酸的物质的量浓度。简要写出操作步骤及需要测定的数据,并写出相应的计算式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com